与新发现的RNA剪接机制有关的乳腺癌的传播
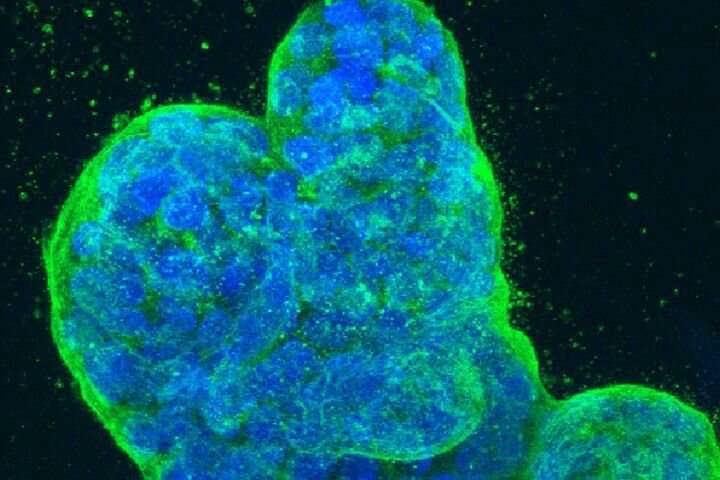
什么杀死了死于癌症的人不是最初的肿瘤。当肿瘤细胞在蔓延到不同器官后,肿瘤细胞在肿瘤细胞连续扩展其数量时,它是难以忍受的疾病负担。
与已知的关于推动早期阶段的特定突变已经着名的癌症增长 - 现在由治疗目标 - 研究人员少了解肿瘤内新异常的持续积累以及他们最终产生的持续积累癌细胞能够通过称为转移的发展传播到身体的其他区域。
近年来,科学家们已经越来越多的关于转移的发现,提高希望能够开发更好的治疗,以挽救具有晚期癌症的生命。事实证明,一种经常在转移中弹出的一种异常肿瘤细胞影响称为替代剪接的过程。
RNA结构驱动多种拼接
替代剪接决定,一旦将该基因的DNA转录到RNA中,该蛋白质将产生哪种蛋白质,该编码模板用于制备蛋白质的细胞内的工厂。与正常发育和功能所需的蛋白质数量相比,人类具有超过20,000个基因,相对较少。细胞可以以多种方式从给定基因中均衡并重新组合从给定基因产生的RNA模板,导致各种替代模板,每个模板各自产生独特的蛋白质。我们依靠这一过程来制造生产我们整个蛋白质的遗传学“食谱”。
科学家们发现,癌症中发生的替代剪接异常模式,导致这些相关但不同蛋白质的异常比例的产生。
在2014年5月14日在线发布的新研究中,由汉尼古德齐,博士领导的研究人员,博士学位,博士教授,生物化学系和生物物理学系的助理教授以及UCSF Helen Diller家庭综合癌症中心的成员,确定了一个特定的由于许多转移情况下,由于异常剪接,所谓的蛋白质的变体过度引起的胸部癌症。在健康组织中,Plectin在确定弹性和机械完整性方面发挥作用。
首先,UCSF科学家使用他们开发的计算技术来分析来自高转移性和较少的转移性乳腺癌细胞的RNA序列和结构。然后,它们鉴定了特定的RNA结构特征,其定义了与转移性癌症相关的替代剪接位点的子集。
“我们发现了一种以前未知的RNA结构,其用于增强拼接,并确定该结构元件在高度转移性乳腺癌中驱动异常的替代剪接,”Goodarzi表示。
通过阻止偏差RNA剪接的部位来停止转移
治疗转移性乳腺癌研究作者建议,可以靶向RNA剪接位点,其产生具有小比特互补的RNA的p1立方体的侵袭促进变体,所述互补RNA与剪接部位序列和块剪接结合。
在团队的实验中,这种方法效果降低了乳腺癌小鼠模型中转移的速率。类似的策略已经用于治疗脊柱肌营养不良症,其中异常替代剪接也起到作用。
在该RNA位点增强剪接的机制也是先前未知的。研究人员发现了一个蛋白质被称为SNRPA1,在正常中发挥作用替代拼接作为所谓的分子的协调集合的一部分,也具有在研究人员鉴定的独特植物相关的RNA基序的侧面喧嚣的剪接。
“我们发现,独立于其着名的功能,SNRPA1是展现的,所有人都在自己,”Goodarzi说。“在乳腺癌的小鼠模型中,我们发现通过将该特异性剪接增强子结合RNA,SNRPA1充当乳腺癌转移的启动子。”
研究人员还分析了来自1,700多个乳腺癌病例的临床资料,并确定了较高水平的SNRPA1与乳腺癌患者的更糟糕的结果有关。
“基本上,这是一种生化途径,驱动我们不知道存在的转移,”Goodarzi说。
进一步探索









用户评论