研究人员揭示α-syn沉积在家族性帕金森病中的机制
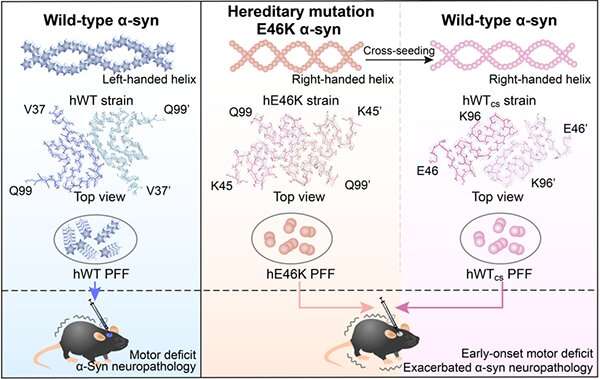
α-突触核蛋白(α-SYN)的淀粉样蛋白沉积是帕金森病(PD)的标志。α-SYN纤维化和大脑细胞对细胞传播在疾病进展中起重要作用。迄今为止,已在家族性Pd(FPD)中鉴定了SNCA的八个单点突变,其特征是早发,严重和高度异质的临床症状。
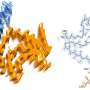
此前,刘聪教授的中国科学院上海有机化学研究所(SIOC)揭示了α-SYN突变,包括E46K,A53T形成不同的原纤维结构,与野生型(WT)α-SYN不同原纤维。无论是如何以及遗传突变诱导的原纤维多态性有助于在FPD中有助于早熟和加剧病理的仍然待阐明。更重要的是,大多数FPD患者对SNCA突变是杂合的,这导致另一个关键问题:突变纤维纤维串联α-Syn在FPD患者中协调神经病理学术语吗?
在最近发表于PNAS5月11日,刘Cong教授和教授他从SIOC Kaiwen团体透露背后的结构性基础cross-seeding WT与火焰之间的突变体αsyn,凸显出纤维结构的重要性确定αsyn神经病理学,并提供机械的理解E46K-associated fPD的病理。
在这项研究中,研究人员发现,人类E46K(HE46K)和人WT(HWT)原纤维菌株在小鼠脑中诱导α-SYN聚集体,不同的形态。与注射HWT菌株的小鼠相比,注射HE46K菌株的小鼠诱导了更多内源性α-SYN聚集和早起的电动机缺陷。
值得注意的是,HE46K原纤维交叉种子HWTα-SYN,并诱导HWT形成HWTCS纤维染色,其在体外和体内复制HE46K模板的结构和播种能力。
这些结果表明,E46K原纤维可以将其结构和种子性质传播到WT单体上,从而放大fPD中的α-syn病理(图1)。
这项工作表明突变菌株的结构和病理特征可以通过WTα-SYN繁殖,使得突变病理能够在FPD中扩增。
进一步探索












用户评论