ShootIn1a - 缺少的链接基础学习和记忆
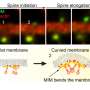
在神经元中,在突触传递中涉及的树突刺小细胞突起的变化 - 被认为是潜在学习和记忆的关键机制。然而,这种结构变化发生的特定方式仍然是未知的。在发表的一项研究中细胞报告,来自奈良科学与技术研究所(NAIST)的研究人员揭示了通过突触结构骨架中的重要接头蛋白质的细胞粘附分子与肌动蛋白的结合对于该结构可塑性的过程至关重要。
肌动蛋白蛋白质构成细胞结构的重要组成部分,或细胞骨架,并且在需要生长或运动时,通过形成微细丝来允许这种结构的动态变化。最初是认为,肌动蛋白的聚合是树突刺响应突触激活而变化大小所需的一切,但是Naist的研究人员发现,单独的方法不足以引起结构可塑性,并决定解决这个问题。
通讯作者稻垣直之(Naoyuki Inagaki)说:“目前的树突棘结构塑性模型没有考虑机械力。”“我们已经确定了shootin1a在轴突生长中的作用,这是一种参与神经元发育的蛋白质,所以我们想调查这种蛋白质是否也可能在树突棘的结构可塑性中发挥作用。”
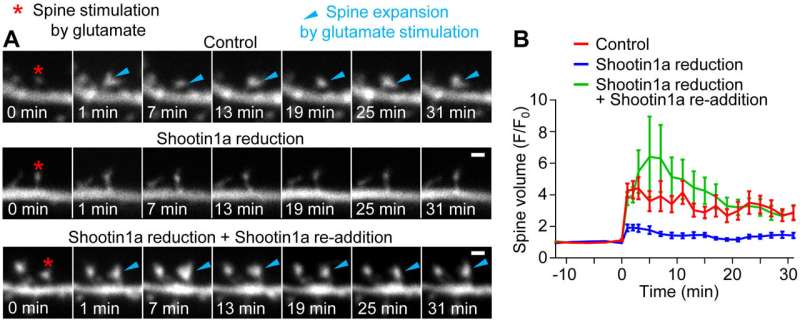
为了探索这个问题,研究人员使用了对照和ShootIn1a敲除啮齿动物的神经元来检查ShootIn1a是否参与树突刺的形成。研究人员希望通过肌动蛋白的杀灭剂介导的偶联在树突状脊柱中确定机械力。细胞粘附分子- 表面蛋白质在突触中结合在一起 - 类似于它们在轴突中观察到的蛋白质。
“结果很清楚,”Inagaki解释道。“我们发现,用树突刺的细胞粘附分子机械地连接肌动蛋白,并揭示了突触活性增强了该偶联,从而允许肌动蛋白长丝推动膜并扩大刺刺。”本研究的结果是第一个将机械力与突触活动依赖性树突联系起来脊柱可塑性并为这些刺的结构可塑性机制提供新的见解。
鉴于活动依赖性树突脊柱可塑性的变化涉及多种神经精神和神经变性障碍,包括自闭症谱系障碍和阿尔茨海默病的疾病,这些发现很重要,因为他们表明ShootIn1a中断可能导致神经障碍的发展。未来研究结构可塑性机制树突刺可能为这些疾病提供新的药物目标。
进一步探索









用户评论