未解除大脑:新研究为阿尔茨海默病提供了希望
自一个世纪以前的阿尔茨海默病发现以来,毁灭性疾病的两个标志已经采取了中心阶段。
首先,称为淀粉样蛋白斑块,是错配的淀粉样蛋白的浓密累积蛋白质,发生于空间之间神经细胞。阻止阿尔茨海默氏症发展的大部分努力疾病有针对性的淀粉样蛋白斑块。迄今为止,所有人都达到了失明失败。
直到最近,第二种经典特质接受了不太审查。它由神经元体内的字符串形成组成,由另一个重要的蛋白质产生的神经元产生。这些被称为神经纤维纤维缠结。
在一项新的研究中,研究人员在生物系统研究所和他们的同事中的ASU-横幅神经退行性疾病中心调查了这些缠结在脑病中,不仅是阿尔茨海默氏症的特征,而且还具有其他神经变性条件的特征。
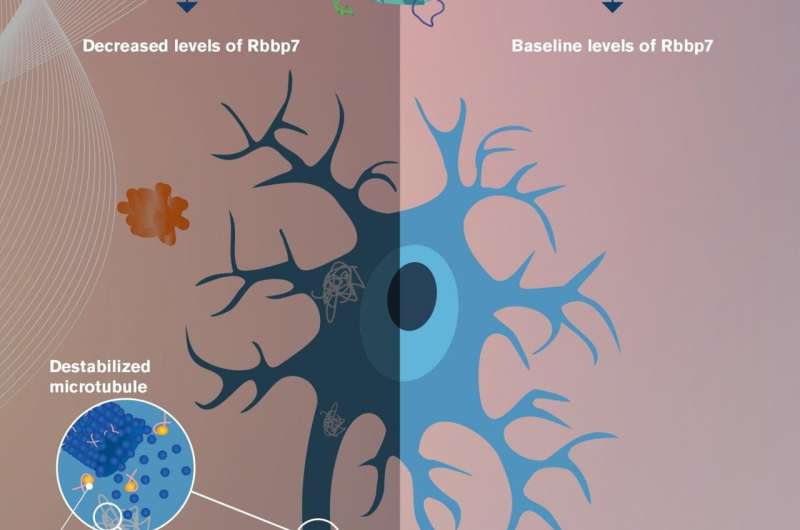
在特定蛋白质中称为RBBP7的研究宿屋,其失呼率似乎与Tau蛋白缠结的最终形成和与阿尔茨海默氏症相关的猖獗的细胞死亡相关联神经退行性疾病。
这项新研究的主要作者Nikhil Dave说:“我们有一种预感,这种蛋白质与阿尔茨海默氏症有关,特别是因为我们知道,与正常大脑相比,阿尔茨海默氏症死后的脑组织中这种蛋白质减少了。”
该研究表明,降低的RBBP7水平与胎体形成和相关的神经元损失和脑重量增加的相关性与阿尔茨海默氏症的患病的大脑之间的相关性。有趣的,细胞损失和缠结形成在转基因小鼠中逆转,其RBPP7水平恢复到基线水平。
该调查结果开辟了新的研究途径,可以帮助开发阿尔茨海默病的有效治疗以及广泛的土地相关痛苦,共同称为帐篷,包括挑选疾病,六颞痴呆症和创伤性脑损伤。
这项新研究发表在本期杂志上acta neuropathologica。
地狱攻击
阿尔茨海默病仍然是医学界最神秘的疾病之一。它的临床症状会在数年的时间内悄然出现,并可以被正常的衰老过程所掩盖。然而,一旦它控制了大脑,这种疾病的发展往往是迅速和无情的。
患者可能会遇到令人困惑的症状范围,包括混乱,身体迷失化,妄想,遗忘,侵略,激动和运动控制逐渐丧失。
研究人员现在知道,当疾病的第一个向外外表变得明显时,阿尔茨海默病已经默默地摧毁了大脑数十年,通常以斑块和缠结的形式留下呼叫卡。
阿尔茨海默病的疾病仍然是痴呆症的主要原因,推进年龄是主要危险因素。这种疾病一直在令人恐惧的向上轨迹,随着预期寿命增加,其他致命的疾病都变得可治疗,如果不是可治疗。目前,根据疾病研究中心,仅有580万人患有阿尔茨海默病的疾病,预计将达到2060年的1400万辆。
除了推进年龄之外的许多其他因素在这种复杂的疾病中发挥着作用,从遗传性易感性到糖尿病和肥胖等血管痛苦。生活方式选择,包括饮食和运动,也可以影响脆弱性。这种疾病通常会折磨那些超过65岁,虽然早期发病版本的疾病可以迅速罢工。
基因组2.0
新的研究审查了神经变性疾病的另一个风险领域,一个对个人基因的一个轴承以及它们的表达方式。虽然在整个生命中弥补了个体基因组的三十亿个字母的DNA规范仍然是固定的,但研究人员现在知道具有各种各样和复杂性的化学信使可以在基因组上采取行动,向DNA提供指导并指导其行为。
这些已知的表观遗传变化可以开启和关闭基因,或调节这些基因产生的蛋白质数量。早期的生物学概念强调的是基因组命运的静态观点,现在已经让位于对生命的新认识,在这种认识中,环境的变化可以深刻地影响我们基因的行为方式。表观基因组对人类健康和疾病的深远影响,科学家才刚刚开始了解。
目前的研究描述了当蛋白质RBPP7的水平降低时大脑发生的表观遗传变化,从阿尔茨海默氏症患者中检测到验尸脑组织中检测到的研究人员。
Rbbp7的一个功能是调节基因表达。它通过改变DNA与组蛋白之间的相互作用来做到这一点,组蛋白就像缝线缠绕在线轴上。当DNA线松散地包裹在组蛋白线轴上时,细胞机制可以读取暴露的DNA信息,并将其转录为信使rna,然后转译为蛋白质。然而,如果DNA线紧紧包裹在组蛋白周围,DNA基因就会被隐藏起来,转录可能部分或全部被阻断,从而降低或破坏蛋白质表达。
研究人员观察到,当RBBP7水平降低时,称为P300的另一种蛋白质的水平增加,导致TAU蛋白的翻译后修饰,称为乙酰化。这的效果是使Tau蛋白从称为微管的细胞结构中分离,Tau通常与之结合。然后,脱离的Tau可以在神经元中累积,最终形成与阿尔茨海默病相关的触发。(参见附带图形。)
低RBBP7引起的乙酰化导致TAU的磷酸化增加,进一步促进肿瘤形成和脑中的神经元损失。
在新的研究中,显示tau病理的转基因小鼠显示Rbbp7水平下降和神经元损失增加。将老鼠体内的Rbbp7恢复到正常水平后,这些病理变化得以逆转,但认知缺陷仍然存在。
Ramon Velazquez是新研究的相应高级作者,推测了这一点的原因是该研究仅针对海马的一个小次区域,而纠结的形成仍然仍然猖獗。“我们计划在未来的研究中查看过度表达RBPP7的全球影响,看看我们是否可以拯救学习,记忆和其他教育方面。”
隧道尽头的光明?
研究中概述的Rbbp7水平与tau蛋白缠结的形成、细胞死亡和认知功能丧失之间的联系脑是引人注目的。结果表明,RBBP7可能是吸毒者发现的有吸引力的目标,以及对阿尔茨海默病的有效疗法和其他土地相关痛苦的发展。基于对这种研究的治疗可以在未来五年内准备好临床试验。
然而,作者强调其他分子参与者可能参与这些复杂的过程。在未来的研究中,研究人员计划进行广泛,无偏见的蛋白质相互作用的探测,从DNA到mRNA的转录途径以及可导致神经变性疾病的表观遗传修饰。
进一步探索













用户评论