分析揭示了跨越诊断类别的白血病的起源

研究人员已经确定了导致儿童和成人急性白血病子集的基因改变。这些白血病以前无法分类,使诊断和治疗具有挑战性。圣裘德儿童研究医院和慕尼黑白血病实验室的研究人员领导了这项研究,研究结果发表在该杂志的网上癌症的发现。
使用集成基因组分析2573例成人和儿童急性白血病结合实验模型,研究人员发现,BCL11B基因的失调是约30%的急性白血病病例的罪魁祸首,这些病例超出了目前的诊断界限。分析表明,BCL11B表达的改变也会导致少量急性髓系白血病(AML)病例的发生。
4%的急性白血病很难用目前的方法进行分类,这些方法依赖于细胞表面标记还有其他特征来区分髓系和淋巴系。这些病例通常被称为混合表型急性白血病(MPAL),谱系不明的急性白血病(ALAL)或早期t细胞前体白血病(ETP-ALL),因为白血病细胞表现出淋巴和髓系的特征。
“我们知道白血病是一种遗传疾病,但许多病例并没有根据其潜在的遗传驱动因素进行分类或治疗,”圣裘德病理学系的m.b.b.s.、医学博士查尔斯·穆利根(Charles Mullighan)说。“对于血统不明的白血病,正确的治疗方法一直不清楚,结果也很差。
他说:“确定这一群体的生物学基础为了解疾病发展提供了关键的第一步。”
Mullighan;Jeffery Klco,医学博士,圣裘德病理学;慕尼黑白血病实验室的Claudia Haferlach和医学博士是这项研究的通讯作者。
这项工作还提供了明确的证据,证明由BCL11B表达驱动的白血病发生在血液祖细胞中,而不是在发育中的T细胞中。在谱系不明的白血病中,细胞的起源一直是研究者们争论的焦点。
BCL11B:放松管制的多种途径
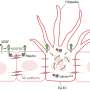
BCL11B编码在T细胞发育中起核心作用的转录因子。BCL11B的表达通常在原始血细胞中被抑制,包括祖细胞。
这种新的亚型被称为bcl11b去调控/重排白血病。该名称反映了导致BCL11B异常表达的多种类型的基因组改变。该分析包括全基因组和rna测序数据,确定了各种结构DNA重排,解除了BCL11B表达的调控。这些包括对多个染色体区域的重排,这些区域包含在血液干细胞中活跃的基因调节区域或增强子。另一个改变是BCL11B基因下游的DNA扩增,产生了一个新的增强子。
研究人员使用Hi-ChIP(一种评估基因组3D结构的方法)来检查染色体环,并显示重排的干细胞增强子在白血病细胞中与BCL11B接触。结果,BCL11B过早表达并没有促使T细胞分化,而是加速了祖细胞向白血病的转化细胞。
研究人员发现了在这种新亚型中经常发生改变的几个基因。最常见的是FLT3基因,在80%的BCL11B病例中发生突变。总的来说,bcl11b重排亚型约占以前诊断为T/髓系MPAL或ETP-ALL病例的三分之一。
哈弗拉赫说:“这些令人兴奋的结果之所以能够取得,是因为我们从不同的角度共同探讨了这个问题,并进行了富有成效的讨论——这是跨大西洋合作的一个完美例子。”
BCL11B的临床意义
FLT3抑制剂用于AML的治疗。未来的研究需要测试这些抑制剂治疗新的BCL11B亚型。先前的研究表明,抑制BCL2蛋白的靶向疗法也可能在未来的治疗中发挥作用。
Klco说:“这项研究表明,有必要摆脱经典的白血病分类方法,采用一种反映急性白血病基因组或生物学特征的统一分子分类。”“在未来,我们希望治疗计划也能适应于特定的分子变化驱动癌症。”