癌症研究表明,新型药物筛查如何个性化癌症治疗
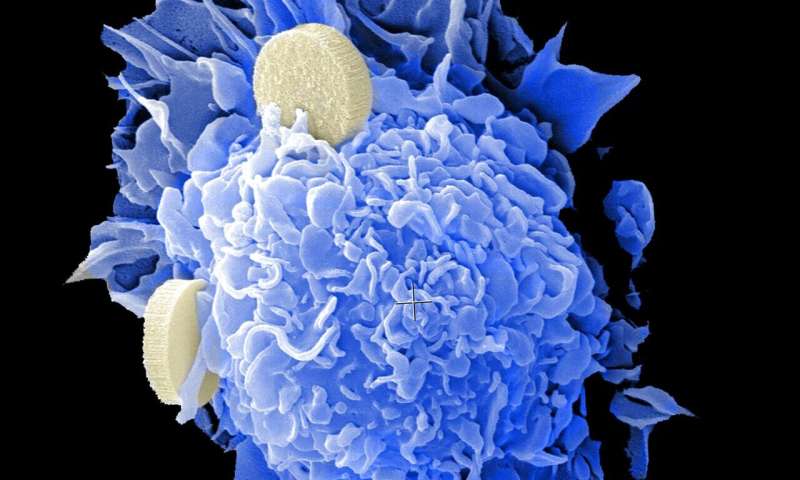
哈佛大学路德维希中心研究人员进行的一项研究表明,如何使用称为动态BH3分析的药物筛查方法来快速识别现有药物的潜在有效组合进行个性化癌症治疗。
“我们知道癌症细胞和健康细胞有不同的新陈代谢。”路德维希哈佛大学研究员安东尼·莱泰(Anthony Letai科学信号传导。“使用BH3分析,我们发现了从患者获得的三重阴性乳腺癌细胞中的特定代谢依赖性,我们可以用现有药物靶向,从而使细胞更容易死亡,并将其引发为第二个靶向药物,然后可以触发其靶向药物死亡。”
Daniels,Letai及其同事还表明,该策略抑制了具有患者衍生肿瘤的小鼠中三重阴性乳腺癌(TNBC)的生长。
尽管肿瘤通常具有独特的代谢适应性,而专门针对那些用药物来定位的脆弱性已被证明具有挑战性。这样的药物常常失败临床试验因为它们的靶向不力或在用作单个药物时杀死癌细胞所需的剂量的毒性不高。
“我们想看看哪种药物扰动代谢会使TNBC细胞更接近垂死,但离开正常细胞丹尼尔斯说。困扰针对癌症代谢的药物开发的毒性。
疗法通常会在癌细胞中诱导一种被称为细胞凋亡的程序性死亡,该死亡由精心制作的蛋白质机械精心策划。但是,细胞还产生抗死亡蛋白,可抑制该机械的关键元素。压力细胞死亡还是生存的是取决于促血管和抗死蛋白的平衡,癌细胞倾向于产生大量的后者以逃避凋亡和抵抗治疗。
BH3 Mimetics抑制抗死蛋白,使平衡以支持细胞自杀。值得注意的是,已经批准了一种BH3模拟物用于治疗某些血液癌,而其他此类药物处于各种发育阶段。
在Letai的实验室中开发的动态BH3分析(DBP)测量了相同的死亡和抗死蛋白平衡,以衡量暴露于药物后患者的肿瘤细胞在患者的肿瘤细胞中如何凋亡。因此,它代表了一种可能一次筛查数百种药物的潜在快速且无偏的方法,以发现最有可能治疗给定患者肿瘤的药物。
Daniels,Letai及其同事使用DBP检查了192种扰动代谢的化合物的“文库”,该化合物在路德维希哈佛大学联合导演Joan Brugge的实验室中开发,以对正常和TNBC细胞的影响。八个破坏了癌细胞的代谢,但使正常细胞不受干扰。
这些药物中的两种靶向一种称为NAMPT的酶,该酶参与了产生NAD+的三种生化途径之一,这是对代谢至关重要的分子。研究人员表明,一些敏感的TNBC细胞系取决于涉及NAMPT的途径。他们还运行了DBP屏幕,以找出TNBC的哪种特定抗死蛋白细胞依赖于NAMPT抑制后的生存。他们使用这些信息来识别最有效的BH3模拟药物与NAMPT抑制剂结合使用。
研究人员使用两种在布鲁格实验室中开发的患者衍生的TNBC肿瘤模型,研究人员表明,只有伴有NAMPT依赖性肿瘤的小鼠对NAMPT抑制剂和BH3模拟物的结合做出了反应。他们建议,被证明是单一药物毒性过于毒性的NAMPT抑制剂可能会被重新定义为在较低剂量的BH3 Mimetics下给予的联合疗法。
丹尼尔斯说:“我们总体而言,我们可以使用DBP找到肿瘤中凋亡启动和特定抗凋亡依赖性的代谢调节剂,因此可以确定代谢化合物和BH3模拟疗法的强大组合。”
Letai的实验室正在使用DBP来识别其他药物组合来治疗各种癌症。因为这是功能性药物屏幕 - 仅检查给定的药物素数是否存在癌细胞死亡 - DBP不需要先验了解癌症的内部工作或遗传畸变。
“我们不必仅限于药品Letai说:“仅通过基因突变才能识别的靶标,这只是癌症世界中真正目标的一小部分。”
他和他的同事们还计划使用DBP进行临床试验,以鉴定诊断为脊髓性白血病的个体患者量身定制的疗法。
莱泰(Letai)和丹尼尔斯(Daniels)指出,路德维希哈佛中心(Ludwig Harvard Center)的常规LAB间会议和协作模型对于研究的概念,设计和行为至关重要。
莱泰说:“这是结合独特的专业知识的一种方式。”“我擅长细胞死亡,不擅长新陈代谢。Veerle擅长代谢和细胞死亡,但缺少一些关键工具来进行她的初步筛查,因此我们转向了路德维希哈佛中心的其他成员,他们实际上拥有那些人。工具。如果我们不在中心,因为哈佛是一个很大的地方,我们就不会意识到这种专业知识。”
进一步探索














用户评论