新的研究为帕金森病的病因和可能的治疗方法提供了线索
来自日本新泻大学大脑研究所的研究人员可能已经揭示了一种新方法,可以彻底改变帕金森病(PD)的治疗、预防,并可能逆转可能导致帕金森病(PD)的损害。这一利用细胞和斑马鱼模型的新发现,证明了线粒体dsDNA泄漏到细胞的细胞质环境中如何导致PD患者脑组织损伤。
帕金森病是第二常见的神经退行性疾病,其患病率预计在未来30年将翻一番。
这些令人清醒的统计数据和对PD预后标志物发现的探索启发了松井秀明教授领导的科学家团队在先前的知识基础上建立了联系线粒体功能障碍和溶酶体功能障碍导致帕金森病。在一次采访中,Matsui教授说:“我们的研究结果首次表明,线粒体起源的细胞质dsDNA泄漏和从溶酶体降解中逸出可以在培养中诱导细胞毒性细胞,以及在斑马鱼模型帕金森氏症。”
Matsui教授继续解释说:“这项研究表明,这种线粒体核物质的泄漏可能是线粒体功能障碍的结果,这可能涉及编码线粒体蛋白质的基因的基因突变或溶酶体中线粒体dsDNA的不完全降解——溶酶体是细胞的‘降解工厂’。一旦泄漏到细胞质中,这种未降解的dsDNA被细胞质的外源DNA传感器(IFI16)检测到,然后触发炎症蛋白编码的mrna上调(I型干扰素刺激的细胞因子,如IL1β)。虽然还需要进一步的研究,但我们假设,随后在细胞质内积累的炎症蛋白可能会导致细胞功能失衡,最终导致细胞死亡。”
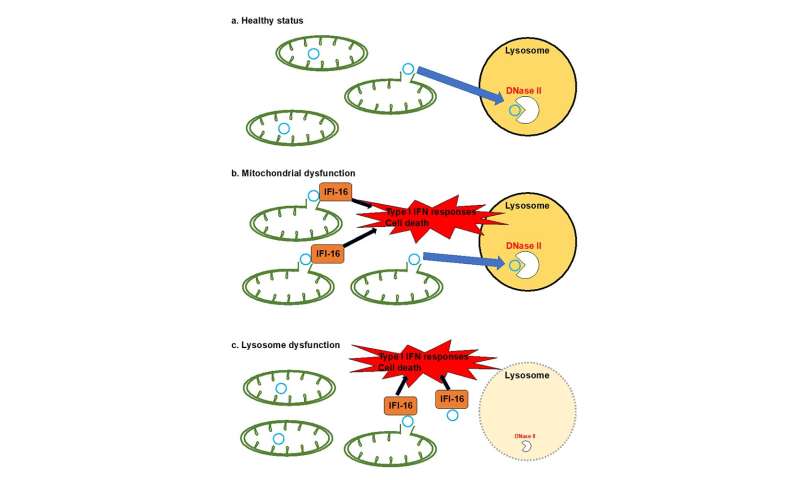
“然而,这种dsDNA泄漏效应可以被dsDNA降解剂DNAse II抵消,”该研究的副研究员Akiyoshi Kakita教授补充道。
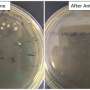
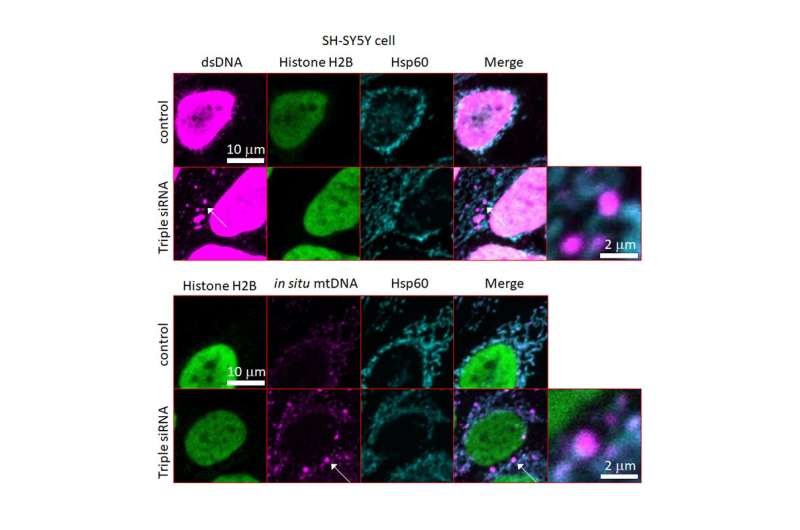
研究的第一部分进行在体外通过敲低GBA, ATP13A和PINK1基因,使用具有线粒体缺陷和溶酶体功能障碍的神经癌症起源细胞(SH-SY5Y细胞)。突变细胞显示dsDNA渗漏,炎性细胞因子积累和细胞死亡。在另外一个比较实验中使用突变细胞(有缺陷的线粒体蛋白)和野生型SH-SY5Y细胞,他们进一步证明DNAse II通过dsDNA的降解拯救了细胞。
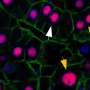
在一项使用PD斑马鱼模型(gba突变体)的验证性研究中,研究人员证明了PD样表型的组合,包括细胞质dsDNA沉积物的积累,在3个月后减少了多巴胺能神经元的数量。最后,他们进一步生成了DNase II突变斑马鱼模型,该模型显示多巴胺能神经元数量减少,胞质DNA积累。有趣的是,当gba突变斑马鱼补充了人DNAse II基因时,人DNAse II的过表达减少了细胞质dsDNA沉积,通过挽救多巴胺能和去甲肾上腺素能神经元的数量,在3个月后挽救了神经降解。
这说明DNAse II可使胞浆中dsDNA沉积诱导的gba突变斑马鱼神经退行性表型恢复。
为了进一步确定PD患者大脑中线粒体起源的细胞质dsDNA的影响,他们对死后进行了检查人类的大脑来自被诊断为特发性帕金森病患者的组织。他们在死后脑组织延髓中观察到线粒体起源的细胞质dsDNA的丰度,IFI16的水平在这些脑组织中也明显升高。综上所述,本研究的结果表明,线粒体起源的细胞质dsDNA在PD大脑中积累,这些dsDNA沉积物和IFI16在人类PD发病机制中发挥作用。
进一步探索