发现了不同大脑疾病的共同机制
范德比尔特大学医学中心(VUMC)的研究人员已经确定了一系列癫痫综合征和神经发育障碍(包括自闭症)的共同机制,这些疾病是由编码大脑中一种重要转运蛋白的基因变异引起的。
他们的发现发表在上个月的杂志上大脑的研究表明,通过遗传或药理手段增强转运蛋白功能可能有利于治疗大脑障碍与这些基因变异有关。
“这为治疗广泛的神经发育障碍(从各种癫痫综合征(和)自闭症到神经发育迟缓和智力障碍)指明了一个明确的方向,这些障碍都是由该基因的病理变异引起的,”神经学和药理学副教授Jing-Qiong (Katty) Kang医学博士说,他也是该论文的通讯作者。
“与基因突变相关的疾病很罕见,目前还没有有效的治疗方法,”康教授说。“如果……我们看到的临床症状只是冰山一角,我们现在知道了背后发生了什么,我们开始知道如何纠正这些问题。”
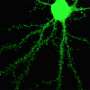
基因,SLC6A1,编码GABA转运蛋白1 (GAT-1)在神经元(神经)的轴突末端(末端)细胞)和星形胶质细胞(星形的神经胶质细胞支持和保护神经元)。GAT-1从两个神经元之间的突触间隙中移除或“重新吸收”主要的抑制性神经递质GABA。
GABA调节整个大脑的神经信号,在正常的大脑发育中起着关键作用。再摄取使大脑能够精确地调节神经递质与GABAA受体的供应,离子通道结合它。
Kang和她的同事广泛研究了GABAA受体,在确定GABA信号中断如何影响大脑功能和发育方面处于世界领先地位。
SLC641变异先前已被证实与一系列癫痫综合征、自闭症和认知障碍有关。但直到现在,科学家们还不知道这些变异是如何导致如此广泛的大脑疾病的。
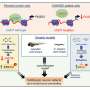
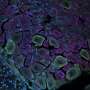
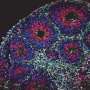
使用高通量分析,如流式细胞术以及一种用于测量神经元和星形胶质细胞GABA再摄取的放射性标记技术,VUMC的研究人员确定了22种不同的SLC6A1变体对来自患有糖尿病患者的几种神经细胞中GAT-1功能的影响神经发育障碍癫痫和自闭症。
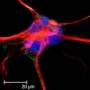
这项工作在患者诱导的多能干细胞中得到验证,这些干细胞被“重新编程”以形成神经元和星形胶质细胞。
研究人员发现,致病变异与导致GAT-1蛋白降解并减少其在细胞表面表达的错误折叠有关。较少的GAT-1反过来又降低了GABA的再摄取神经细胞星形胶质细胞和被破坏的神经递质功能。
“这是对SLC6A1病理变异的首次大规模研究,”Kang说。“我们的工作表明,slc6a1介导的疾病是恢复细胞表面功能转运体的药理学和基因治疗的良好候选者。”
在VUMC上发现的一种化合物,可以纠正小鼠模型和尿素循环紊乱患者细胞中的GAT-1功能,目前正在临床试验中进行测试。这种遗传疾病会导致血液中氨的积聚,从而损伤大脑,可能是致命的。
另一种潜在的方法是使用反义寡核苷酸,这是一种短的、合成的遗传物质片段,可能会增加正常的“野生型”GAT-1蛋白的表达。
康说,如果没有两位“英雄”母亲的帮助,这项研究是不可能完成的,她们的孩子都患有罕见遗传疾病:丹佛倡导组织SLC6A1 Connect的创始人兼首席执行官Amber Freed;特里·乔·比希尔博士是纳什维尔COMBINEDBrain公司的创始人兼董事,该公司支持大脑研究。
“我很幸运,也很荣幸能和他们一起工作,”康京和说。“他们教会了我很多东西,激励我去做有意义的研究。”
弗里德回应说:“她爱SLC6A1的孩子,就像她自己的孩子一样,她无私地努力改善他们的生活,就像一位母亲一样迫切。”“在这段旅程中,凯蒂一直是一个充满爱心的人、好奇的科学家和力量的支柱。”
比希尔补充说:“这种同理心使她的发现在大流行中不断取得进展。”她会骑着自行车去实验室,在晚上、周末甚至假期照顾小鼠和细胞模型。Kang所做的是基础科学研究,这些研究将转化为她遇到并拥抱过的真正孩子的真正治疗方法。”
Felicia Mermer和Sarah Poliquin是这篇论文的第一作者。VUMC的其他合著者有Kathryn Rigsby、Anuj Rastogi、Wangzhen Shen医学博士、Alejandra Romero-Morales、Gerald Nwosu和Vivian Gama博士。