一种“泵”基因在大脑早期形成中发挥了令人惊讶的作用

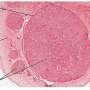
在多小脑回症中,大脑皮层有许多不规则的小褶皱(脑回)和层的紊乱。许多受影响的儿童有严重的发育迟缓、智力障碍和癫痫,许多儿童需要使用轮椅。几种不同基因的突变会导致这种“大脑过度折叠”的情况。
理查德·史密斯(Richard Smith)博士在研究四名患有多微回症的患者时,发现了一种基因突变,导致他多看两眼。他的好奇心驱使他去研究这种名为ATP1A3的基因在发育中的大脑中所起的作用。
“ATP1A3对许多细胞都至关重要生物过程史密斯说,他是波士顿儿童医院遗传学和基因组学部门的研究人员。“这是我们大脑中最重要的基因之一。”
生物电和大脑发育
ATP1A3编码一种蛋白质,这种蛋白质构成细胞泵的一部分。它移动钠钾离子在整个细胞膜使我们的细胞在两侧保持不同浓度的带电离子,就像电池一样。这一差异使电流能流入或流出电池,驱动动作电位在神经元和其他基本细胞功能中。
“对我来说,了解这些泵送蛋白质和离子流动是如何促进大脑发育的核心机制是非常有吸引力的,”史密斯说,他是一名训练有素的电生理学家。“通过研究这四个病人,我们得到了很多伟大的生物学见解。”
ATP1A3的时空“图谱”
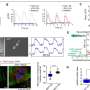
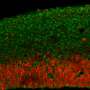
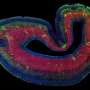
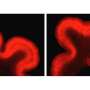
在典型的时间和地点大脑发育ATP1A3打开了吗?为了回答这个问题,史密斯和高级研究员克里斯托弗·沃尔什(Christopher Walsh),医学博士和其他多个地点的同事,从几家医院组织库和NIH神经生物库获得了捐赠的人体组织。调查人员分析了早期两次的样本大脑发育:大约在妊娠20周时,最初光滑的胎儿皮层开始折叠,以及在婴儿出生后不久。
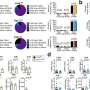
他们与哈佛医学院的Marta Florio博士合作,使用单细胞RNA测序(DropSeq),在产前皮层的11个区域的约125,000个神经元中寻找ATP1A3的表达(启动)。他们还分析了婴儿的52000个神经元,对大脑皮层的四个区域进行了采样。
总的来说,在两个时间点,ATP1A3在前额叶皮层的表达水平都是最高的,在皮层中最活跃、最频繁放电的神经元中表达水平也最高。在胎儿皮层中,ATP1A3在基底板中表达特别高,基底板在发育后期消失。基底中的电活动被认为是驱动突触形成、神经元迁移和其他大脑发育过程的信号中枢。
“在婴儿中,我们发现该基因在中间神经元中表达增加,而中间神经元是抑制性的,”史密斯说。“我们认为,ATP1A3突变可能会破坏大脑中兴奋和抑制的平衡,这可能会导致其他与ATP1A3相关的情况下的癫痫。”
其他atp1a3相关疾病的教训?
这项工作,发表在PNAS,强调了罕见病的研究如何能产生生物学的基本见解——在这种情况下,大脑是如何形成其轮廓和组织模式的。它为未来研究ATP1A3突变如何引起的大脑形成异常。
史密斯说:“当我们第一次以预印本的形式出版它时,有很多患者与我们联系,他们有重叠的表型,所以更好地了解这种疾病是非常令人兴奋的。”
这些发现也可能有助于科学家了解其他已知的atp1a3相关疾病。多微回症患者有严重的突变,导致基因功能丧失,较轻微的突变导致一系列晚发神经系统疾病,包括儿童交替偏瘫,它会引起间歇性的暂时瘫痪;一种运动障碍,称为快速发作性帕金森肌张力障碍;和儿童精神分裂。这些晚发性疾病可能更适合于治疗干预。
“多微回症处于严重程度的极端末端,但我们认为,在这一谱系的“中间”的atp1a3相关疾病可能具有早期致病根源,可能在它们变得更严重之前得到治疗,”史密斯说。
他补充说,如果新生儿DNA测序当ATP1A3相关疾病变得普遍时,它可能为在临床表现之前治疗它们提供了一个机会之窗。
至于多微回症,“结构畸形更难扭转,但婴儿的大脑具有惊人的可塑性和重组能力,”史密斯说。“所以,如果你能从最早期的点上减少癫痫相关的损害,你就有可能提高生活质量。”
进一步探索