减少tau蛋白能预防帕金森氏症和路易体痴呆吗?

一项新研究发表在杂志上eNeuro,这表明答案是否定的。如果这被证实,这一结果与阿尔茨海默病不同,在阿尔茨海默病中,大脑神经元中内源性tau蛋白水平的降低对多种疾病模型具有保护作用,这进一步表明tau蛋白在路易体痴呆发病机制中的作用与阿尔茨海默病不同。
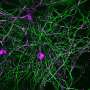
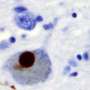
帕金森病痴呆和路易体痴呆都以细胞内聚集物错误折叠为特征α-突触核蛋白的蛋白质在大脑神经元这两种疾病加在一起是神经退行性痴呆的第二大常见原因,仅次于阿尔茨海默氏症。
阿拉巴马大学伯明翰分校的研究人员在神经学副教授Laura Volpicelli-Daley博士的带领下,使用了她11年前开发的帕金森病模型。Volpicelli-Daley应用了极低浓度的改变α-突触核蛋白在体外或体内神经元中,它都呈现出病理形态。的神经细胞取一些纤维。在细胞内,改变的α -突触核蛋白就像一颗种子,吸引天然存在于神经元中的可溶性α -突触核蛋白。这将可溶性的突触核蛋白转化为病理的,不溶性的聚集物,损害神经元功能,并导致细胞死亡.这些修饰过的α -突触核蛋白包体与帕金森患者死后大脑中发现的形态相同。
这种疾病模型被称为模板α -突触核蛋白包涵体形成,用于比较产生正常数量tau蛋白的神经元,与缺乏一个或两个tau基因的突变神经元,从而具有较少或没有tau蛋白。如果内源性tau蛋白有助于疾病进展,则杂合或敲除tau蛋白突变体有望显示保护作用。然而,UAB的研究人员没有发现与野生型对照的差异。
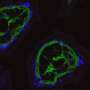
在他们的研究结果中,研究人员首次表明,在细胞中tau蛋白和α -突触核蛋白之间确实存在相互作用——这两种蛋白质都位于原代培养神经元的突触前末端和小鼠大脑皮层中,这与之前从人脑制备中得到的结果一致,并且几项体外研究表明这两种蛋白质相互作用。
然而,tau蛋白的减少或完全缺失并不能阻止体外生长的原代海马神经元中纤维蛋白诱导的α -突触核蛋白包体的形成。在小鼠中,在注射纤维蛋白6周或6个月后测量,tau蛋白的减少或缺失也不能阻止纤维蛋白诱导的大脑运动控制或边缘区域的α -突触核蛋白形成,包括皮层、杏仁核、海马体和黑质致密部。
最后,虽然小鼠模型中的α -突触核蛋白原纤维导致一半产生神经递质多巴胺的野生型神经元死亡,但tau杂合或tau敲除小鼠中的多巴胺能神经元显示出相同数量的神经元死亡,这意味着没有保护。此外,减少tau对具有纤维诱导的α-突触核蛋白包体的小鼠的行为表型没有任何重大影响。
“在这里,我们已经证明内源性tau蛋白的减少并不影响模板化α -突触核蛋白包体的形成或多巴胺的损失神经元Volpicelli-Daley说。“这表明针对帕金森病的tau治疗可能比减少tau更复杂。这与阿尔茨海默病不同,在阿尔茨海默病中,减少tau蛋白被认为是一种可能的治疗方法。”
进一步探索