罕见的结肠直肠癌亚型识别机制发展
新泽西州罗格斯大学癌症研究所的研究人员,政府只是国家癌症Institute-designated综合癌症中心,最近发现了一种机制来解释驱动器粘液性结直肠腺癌(MAC)的形成,一种罕见的亚型结直肠癌(CRC),并确定了基因的监管机制。OnlineFirst版本的这项工作是发表在8月20日癌症研究。
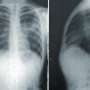
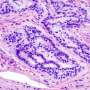
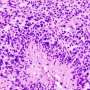
根据美国癌症协会,结肠直肠癌(CRC)的第三大原因癌症在男性和女性有关的死亡在美国。MAC是一种独特的和侵略性的CRC,占10 - 15%的患者(Nat牧师肿瘤防治杂志2016年6月,)。它的特点是过度分泌的蛋白质称为粘蛋白,一个完全不同的分子签名或生物行为比经典的CRC。是什么驱使MAC肿瘤的形成是目前未知和未开发。
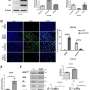
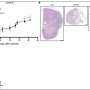
使用小鼠模型,研究人员在这项研究表明,肿瘤抑制蛋白的损失称为FILIP1L诱发结肠上皮增生和粘蛋白的分泌。他们还表明,FILIP1L刺激分子伴侣蛋白的降解称为PFDN1。这种崩溃导致异常稳定PFDN1导致高粘蛋白分泌和缺陷在结肠癌细胞的细胞分裂。这些缺陷镜子相同特征中看到积极的MAC形式。作者指出这些发现强烈暗示FILIP1L MAC肿瘤发展的重要调节器。
“降低生产FILIP1L与化疗耐药性的,在卵巢癌、结肠癌预后不良。阐明大肠癌的粘液腺癌发展背后的驱动程序使研究人员能够探索目标这一机制和发展急需的疗法对于这个特定的患者人群,”该研究的主要作者Mijung Kwon博士说,罗格斯大学癌症研究所的研究员和罗格斯大学医学助理教授罗伯特·伍德·约翰逊医科学校。
“我们实验室已经发表的证据(PMID:18794120,21693594,24327474,24340050,25200207和27776341)FILIP1L扮演了一个角色在胰腺等其他类型的癌症,肺癌、乳腺癌、卵巢癌和前列腺癌。识别一个FILIP1L和粘液性结直肠腺癌之间的联系进一步增强我们对角色的理解这部小说肿瘤抑制在这些癌症的发展,“笔记新泽西州罗格斯大学癌症研究所主任Steven k .切除,医学博士,流式细胞仪,也是肿瘤服务高级副总裁RWJBarnabas健康、副校长对癌症程序对罗格斯大学生物医学和健康科学,和资深作者的工作。
作者还在继续探索这个机制在人类肿瘤样本和演进的小鼠模型,希望他们的工作可以带来新颖的治疗和诊断方法。
更多信息:Mijung Kwon et al, FILIP1L损失是咄咄逼人的司机粘液性结直肠腺癌和介导胞质分裂通过PFDN1缺陷,癌症研究(2021)。DOI: 10.1158 / 0008 - 5472. - 21 - 0897