Sotrovimab COVID药物,政府在澳大利亚买了在批准使用

澳大利亚目前有药物治疗COVID的症状,并从其他疾病重新改造的药物。现在政府已经把早期一种新药,sotrovimab,作品COVID-19体内的病毒颗粒。
的联邦政府有买了7700剂so-tro-ve-mab sotrovimab(明显),今年首次交付由于一些时间。
但是,COVID-19临床证据特遣部队说的太初步的临床试验结果药物进入常规使用。专家组说,直到进一步的证据显示sotrovimab是有效的,它只能给病人作为人类临床试验的一部分。
什么类型的药物是吗?
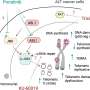
Sotrovimab是一个新开发的单克隆抗体的药。这意味着它停止导致COVID-19的病毒的作用。
抗体是一种蛋白质的免疫系统。抗体可以识别和连接到另一个类型的蛋白质称为抗原。
当抗原抗体高度,它引发了一系列反应,可用于治疗相关的疾病。
单克隆抗体药物已经建立在现代医学用于治疗疾病,如关节炎和癌症。
另一种单克隆抗体药物叫用于治疗炎症的症状吗与COVID-19。
sotrovimab如何对待COVID ?
Sotrovimab通过绑定上的突起蛋白COVID-19外的病毒。这是相同的峰值蛋白质人体的免疫系统与辉瑞训练识别COVID疫苗。
通过绑定的蛋白质,sotrovimab可以阻止病毒进入人类细胞粘附和。这阻止了病毒在体内的复制。
如何sotrovimab给定的副作用是什么?
美国食品和药物管理局已批准sotrovimab紧急使用作为一个高危患者静脉注射治疗COVID-19严重疾病的进展。

Sotrovimab可以尽快有人收到测试结果为阳性或十天内得到COVID-19症状。
最常见的副作用与sotrovimab皮疹和腹泻。病人也需要密切监测注射后严重的过敏反应。
临床试验显示到目前为止什么?
2021年5月,制药公司葛兰素史克公司发布的数据临床试验。583年它sotrovimab相比安慰剂高危COVID-19病人是否阻止疾病进展的程度,患者需要住院治疗或死亡。
sotrovimab组(291人),三个病人的疾病进展,21相比安慰剂组(292人)。这相当于一个减少85%患者的疾病进展的轻度至中度COVID-19。
它已经获得医疗监管部门批准吗?
今年5月,这两个我们和欧洲药品监管机构授权sotrovimab用于成人和儿童12岁以上患有轻度到中度COVID-19,但谁是在一个较高的发展为重症COVID-19的风险。这包括65岁以上的人,和那些有某些疾病如心疾病、肥胖、哮喘和糖尿病。
澳大利亚的监管机构——商品管理(TGA)、治疗收到一个应用程序葛兰素史克公司的临时注册药物在澳大利亚,然而其使用仍限于研究设置。
这是什么意思对澳大利亚吗?
昨天联邦卫生部长格雷格·亨特宣布政府购买了7700剂量的sotrovimab,基于推荐的科学与工业技术咨询小组。
目的是让TGA批准的药物可以使用一次。
但是,COVID-19临床证据特遣部队,临床治疗指南的COVID-19在澳大利亚,有担忧”的影响sotrovimab patient-relevant结果治疗COVID-19”和未经证实的治疗的潜在危害。
外面说sotrovimab不应使用适当的随机临床试验伦理批准:“试验需要在特殊人群,包括儿童和青少年、孕妇和哺乳期妇女,老年人脆弱和那些接受姑息治疗。直到进一步的证据是可用的,不要使用sotrovimab治疗COVID-19在这些人群中,除非他们有资格参加试用。"
因此,sotrovimab只能进入主流使用在澳大利亚当第三阶段的全部结果临床试验是已知的。数据将重要的TGA确定药物的工作方式,以及它是否比当前的治疗。