小细胞群在触发遗传MDS病例的沉默子集中起着主要作用
在美国,多达18.7万人患有骨髓增生异常综合征(MDS),这种疾病会破坏骨髓产生健康血细胞的能力。
在大多数情况下,MDS是由突变在人的一生中产生于血液干细胞。这些患者出现贫血、疲劳和其他并发症,MDS诊断的典型年龄为70岁及以上。然而,大约2%到5%的MDS患者生来就带有使他们易患某种MDS的突变,但即使是他们也要到60岁才会出现症状。
2016年,其他科学家记录了患有这种遗传形式的成人MDS的人在DDX41基因上有相同的突变,但尚不清楚这些突变在其中扮演了什么角色。现在,辛辛那提儿童癌症和血液疾病研究所的专家领导的一项研究于2021年9月1日发表在细胞干细胞解释了它的重要性。
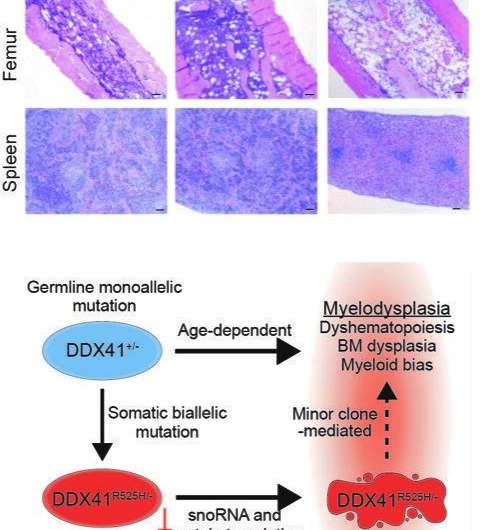
他们的发现是建立在大量工作的基础上,以开发一个更准确的小鼠模型由DDX41突变引起的人类MDS。这种疾病的一个重要方面似乎依赖于在其另一个DDX41基因拷贝中获得额外突变的细胞,从而产生具有两个DDX41突变的血液干细胞。
研究小组推断,这些细胞在患者的骨髓,会间接影响骨髓的其余部分,引发造血异常。这样,这个小的细胞群可能成为MDS的驱动因素。他们的研究结果表明,针对这些微小的细胞群可能会导致一种预防MDS的治疗方法。
这项研究的资深作者Daniel Starczynowski博士说:“基本上,这些罕见的细胞帮助创造了一个被污染的骨髓环境,反过来允许其他具有mds相关基因突变的干细胞繁荣发展。”“如果没有这些触发细胞的存在,骨髓可能会继续正常地制造血细胞,就像病人一生中那样。”
虽然这项研究的重点是MDS,但具有不同突变组合的细胞之间类似类型的串扰可能在其他疾病中发挥作用。
Starczynowski说:“据我们所知,这是第一个证明MDS的遗传或新生形式可以由骨髓中的疾病修饰小克隆介导的证据。”
MDS是什么?
骨髓增生异常综合征包括一组损害骨髓功能的疾病。大约75%的病例发生在60岁以上的人群中,但这种情况也会影响儿童和年轻人。大约三分之一的MDS发展为急性髓系白血病(AML),MDS基金会的消息。
有时MDS是癌症放疗或化疗的副作用。有些病例可能与接触有毒环境或范可尼贫血等罕见遗传性疾病有关。然而,在大多数情况下,MDS的原因仍然未知。
晚期MDS需要骨髓移植。没有骨髓移植的患者平均存活率为6年左右,但有些患者可能在几个月内死于快速骨髓衰竭。
检测无声触发
Starczynowski和他的同事多年来一直在研究MDS。在从该领域的其他研究中了解到DDX41基因的遗传突变与MDS相关后,该团队开始开发小鼠模型,希望更多地了解该基因突变。
“带有这种额外DDX41突变的细胞并不占骨髓的大部分。事实上,很难让这种突变组合的细胞生长,”该研究的第一作者Tim Chlon博士说。“当我们意识到这些细胞在患者骨髓中很罕见时,我们认为这些细胞和骨髓中其他细胞之间发生的串扰可能在疾病的发生中发挥了作用。”
老鼠实验证明了这一点造血干细胞DDX41基因的两个拷贝都发生突变,其制造新蛋白质的机制(称为核糖体)都有缺陷。这阻止了干细胞的增殖和形成正常数量的新血细胞。由于这些细胞不能有效繁殖,它们本身不会引起骨髓衰竭,但它们会影响骨髓中的其他细胞骨骨髓和贡献无效血细胞生产。
这一过程可能有助于解释为什么MDS患者在成年后期突然发病前感觉完全正常。
下一个步骤
研究小组计划进一步研究,以确定是否有针对性细胞将改变小鼠模型中MDS的进程,如果成功,可能会导致潜在的人类药物开发。
这一发现也可能成为其他研究的跳板,以寻找可能被忽视的微小细胞群和它们更丰富的追随者之间类似的相互作用。
进一步探索