新生活的抗癌药物重组疼痛通路治疗慢性疼痛
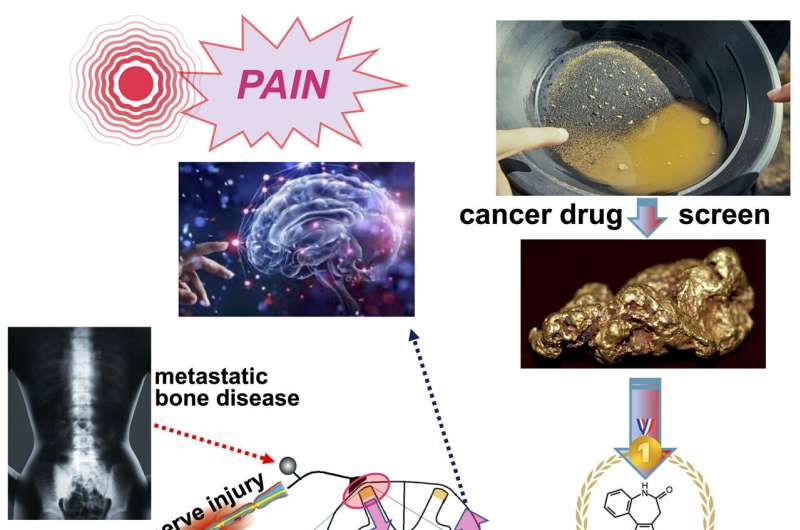
慢性疼痛与神经损伤和慢性骨疼痛转移性癌症的未满足的医疗需求。这种清醒的断言不开始捕捉这些疼痛的破碎和毁灭性的影响人们的生活受到他们的影响,还是对他们的家庭的影响。事实上,人们的社交和职业生活可以颠覆了这些条件。
一个病人与癌症metastasis-induced骨头疼痛将其描述如下:
“我只是不能在床上睡了因为疼,我的脊椎疼躺下,坐起来,睡眠更疼。白天,我有常数脑雾,打断了疼痛,几分钟后变得更糟的,恒定的灼痛,恶化的背景下,下午和晚上。我伤害了更多当我去洗手间。的止痛药使我的大脑雾更糟。我感觉像一个僵尸。我严重便秘和痒。”
同样,慢性患者神经损伤由于糖尿病周围神经损伤引起的疼痛,不良副作用的药物,或严重带状疱疹形容他们的生活被颠覆了棘手的痛苦。
因此,显然有一个新的疼痛缓解治疗的必要性。关于所需的概要文件的潜在新止痛药,“新药物和其他治疗方法慢性疼痛需要安全,即。,the fewer side effects the better. It is especially important that they be non-addictive and non-sedative, while being effective against nerve injury pain and cancer pain, preferably with a minimal time to official approval. Because chronic pain, like many chronic diseases, has an important root in genetic switches being reprogrammed in a bad way, a disease modifying treatment for chronic pain should reset the genetic switches, not just cover up the pain, as with opioid and aspirin/Tylenol-like painkillers." says Wolfgang Liedtke, who practiced pain medicine for the last 17 years at Duke University Medical Center and directed the former Liedtke-Lab to elucidate basic pain mechanisms (now an executive at Regeneron Pharmaceuticals, since April 2021).
利特克公爵的团队,与同事共同从加州大学欧文分校,解决这种疼痛问题,从调查的“抗癌药物的垃圾场”,有可能会使用。两个化合物库中包含的测试了1057种化合物的国家癌症研究所。利特克是研究癌症药物特别感兴趣,因为他们相当多的表观遗传调控的基因影响。除了阻止快速分裂癌症细胞从繁殖,这种表观遗传效应可以重置不适应的遗传开关非区分神经细胞。
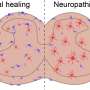
识别有用的候选人anti-pain药物从这个池开始,利特克的研究小组发明了一种筛选方法,它依赖于神经元(神经细胞)转基因小鼠。这些细胞有“敲入”修改,使他们作为一个方便的报告基因系统。具体来说,化合物增强anti-pain目标基因的表达触发这些细胞生物冷光信号来生成一个可衡量的。所选anti-pain目标基因在这些细胞触发Kcc2,氯化合成一个挤压转运分子,KCC2。氯化KCC2分别从神经元。低氯水平内神经元抑制神经传递。健壮和强壮的抑制性神经传递时疼痛通路,疼痛信号是沉默。基本上在所有形式的慢性疼痛研究实验动物和人类脊髓模型,KCC2消失的神经元组成主背侧脊髓疼痛门。
在测试上述1057种化合物的记者系统,利特克的研究小组发现了137,增强Kcc2的表情。迭代重新测试指出了四个非常有前途的候选人。其中,Kenpaullone被选为深入检查由于其强大的保护神经元在多个实验模型的记录。
在老鼠中,利特克的研究小组发现,Kenpaullone有效运作对疼痛神经收缩造成的损伤和疼痛引起的癌症细胞在股骨播种。缓解疼痛是深刻的、持久的和旷日持久的出现,符合药物对基因调控产生影响。利特克说,
“在这个阶段,我们知道我们遇到我们搁置屏幕癌症药物的基本要求,即确定Kcc2基因expression-enhancers,证明他们在有效的止痛剂临床疼痛模型。”
因此鼓励,利特克的团队评估Kenpaullone是否会影响脊髓疼痛和处理,随后,Kenpaullone治疗是否可以降低神经创伤性氯水平的海拔pain-relaying神经元。两组实验成果成功地肯定。
取得这些幸运的发现,研究者试图澄清Kenpaullone如何增强Kcc2基因表达。他们发现潜在的信号机制,没有前面描述的一个关键要素。简单地说,他们发现Kenpaullone抑制GSK3-beta,一种磷酸添加标记的酶蛋白;磷酸标签有一个强有力的function-switching效果。他们发现GSK3beta磷酸添加标签delta-catenin (delta-CAT),当以这种方式标记,是注定要毁灭的细胞。因此,在慢性疼痛中,激活delta-CAT GSK3-beta导致损失的痛苦传递神经元。利特克的研究小组证明Kcc2 delta-CAT的原始的函数关系表达式和疼痛信号的传送。也就是说,它们表明non-phosphorylated delta-CAT运送到细胞核直接绑定到Kcc2基因,其启动子区域的开关在关闭Kcc2基因的表达。
调查的相关性这对疼痛通路,利特克和他的同事们设计了一个gene-therapeutic方法中加载一个病毒,称为AAV9基因治疗的病毒载体,与phosphorylation-resistant delta-CAT。感染脊髓背角神经元AAV9驾驶phosphorylation-resistant delta-CAT,他们注射到小鼠的脑脊液。值得注意的是,他们发现这个基因治疗实验Kenpaullone镇痛效果相似。这些发现表明,Kenpaullone和similarly-acting kinase-inhibitory化合物,以及delta-CAT基因治疗,有可能成为我们的新工具的工具箱对慢性难治性疼痛,包括神经损伤疼痛和癌症骨疼痛,可能与其他形式的慢性疼痛(三叉神经疼痛)与低Kcc2表达式。这种方法也可以有效的对其他神经和精神疾病,这种机制似乎有助于疾病。
研究结果发表在自然通讯。
更多信息:再利用抗癌药物标识kenpaullone改善病理性疼痛的临床前模型通过抑制神经传递正常化,自然通讯(2021)。doi.org/10.1038/s41467 - 021 - 26270 - 3