蛋白质参与心脏发展促进干细胞心脏修复的策略
随着年龄的增长,人的心逐渐失去其损伤后自我修复的能力。损伤造成的伤害如心肌缺血和心脏病,与氧含量减少有关的心脏,会导致心脏功能低于正常能力,使患者很难开展日常活动。
增加心脏缺血性损伤后修复,研究人员转向干细胞疗法,用新的代替死去的心脏组织,功能组织。在大多数情况下,然而,只有不到1%的干细胞移植到心脏,生存主要原因是细胞无力应付缺血性的代谢需求的环境。
现在,在新的研究中,科学家们在刘易斯Katz天普大学医学院表明,至少在老鼠,这种障碍是可以克服的,重新LIN28-a蛋白质通常表示在发展中心脏在干细胞来自成人的心脏组织。LIN28呈现成人心脏干细胞代谢更为灵活,大大提高了它们的生存机会。
“LIN28非常活跃的发展中心,但不是在成年人的心脏,”解释莫辛汗博士,心血管科学助理教授刘易斯·卡茨医学院心血管研究中心高级研究员在这项新研究。“我们发现,当我们表达LIN28心脏干细胞在成人心脏组织,成人细胞重新编程有年轻的代谢特点,发展心脏细胞。这个过程实际上是像反向老化。”
新的研究结果发表在《华尔街日报》生物氧化还原。
胎儿的心脏是专门适应函数在低氧条件下。产后,这种低氧耐受是输了,但是,成年后,心脏对氧的减少可用性非常敏感。细胞代谢的变化是这一转变的根本原因,和最近的研究表明,这些心脏代谢差异有助于确定干细胞移植后的命运。
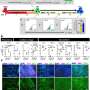
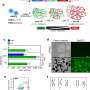
在新的研究中,汗博士和他的同事们发现代谢监管者是否感兴趣表示发展中心脏传授一种心脏代谢灵活性tissue-derived干细胞样细胞(CTSCs)。CTSCs都出现在新生儿和成人心脏组织只有表达LIN28发展中心。在成人心脏组织,CTSCs拥有再生潜力,通常是休眠状态。
团队开始重新LIN28表达式在成年小鼠CTSCs体外和分析对信号通路的影响参与细胞新陈代谢,生长和再生。他们发现LIN28表达式产生一个健壮的再生反应,修改CTSCs促进生长和存活对氧化应激的反应。研究人员联系修改Let7 /基因信号通路,这是众所周知的,调节细胞的有氧代谢。移植LIN28-expressing CTSCs老鼠遭受心脏心脏病导致心脏结构和功能的重要改进。这些影响通过相同的通路介导的体外评估。
“CTSCs LIN28修改能源生产,导致分泌的许多因素有利于心脏细胞生存,”汗博士解释道。“总的来说,细胞了一个更年轻的表型。”
汗博士计划下新发现转化为更大的动物模型,并确定是否来自人体的心脏干细胞可以通过LIN28重新编程。“这些研究可能对于我们干细胞治疗方法具有重要意义心疾病在人类,”他说。
进一步探索