这一发现可能会扩大癌症患者干细胞移植的供体库

长期以来,癌症医生一直不同意来自无症状血液疾病(称为克隆造血(CH))捐赠者的干细胞移植是否会使受者面临后续健康问题的风险。这种担忧甚至促使一些移植中心将这些人排除在捐献者之外。
在一项新的研究中,达纳-法伯癌症研究所的研究人员表明,在大多数情况下,这种移植是安全有效的。令他们惊讶的是,他们还发现如果移植的细胞如果携带一种特定的基因突变,接受供体的人通常比没有感染丙肝的人复发的风险更低临床肿瘤学杂志这可能会扩大潜在捐赠者的范围。
克隆性造血是一种与年龄有关的疾病,当人们的血液中出现白血病相关基因突变时,即使他们没有白血病或其他血液相关癌症。到目前为止,CH主要在非移植患者中进行研究。这些研究表明,40岁以上的人有一小部分血细胞带有这些突变是很常见的。然而,当其中一种突变的血细胞比例很高时,患者在未来患血癌的风险就会增加,也会出现非癌性疾病,如癌症心血管病.
之前的研究表明干细胞来自患有CH的捐赠者的血液可以在移植受者体内生根或植入,但尚不清楚它们是否会增加受者患白血病的风险,以及它们如何影响移植受者的移植后免疫功能。由于担心CH的健康风险可能转移到接受者身上,一些医生不愿意接受患有CH的老年人作为捐赠者。
这项新研究的资深作者、达纳-法伯医学博士R. Coleman Lindsley说:“对于大多数患有高风险血液[血液相关]恶性肿瘤的患者来说,移植供体造血[血细胞形成]干细胞是唯一有治愈潜力的治疗方法。”“如果供体年龄在45岁以下,患者往往会做得更好,但当没有更年轻的供体时,最好的选择可能是一个非常匹配的年长兄弟姐妹或亲戚。
“有强有力的证据表明,无性造血可以从供体传播到受体,但很少有人知道这对受体可能产生的影响。在这项研究中,我们试图评估这种影响。”
研究人员从1727名年龄在40岁及以上的捐赠者身上提取了干细胞样本。在每个样本中,他们分析了46个常见于CH的基因突变。他们发现388名捐赠者(占整个群体的22.5%)患有CH。最常见的突变基因是DNMT3A(占14.6%)和TET2(占5%)。
然后,研究人员评估了这些捐赠者中102人的突变是否在移植后3个月和1年后仍然存在于受者体内。
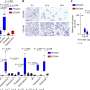
林德斯利说:“我们发现,来自供体移植的CH克隆中有85%已被植入。”“出乎意料的是,我们还发现,与接受非ch移植的患者相比,当至少1%的移植细胞具有DNMT3A突变时,患者的总体生存时间更长,这种影响是由于疾病复发的几率较低。”
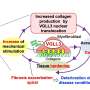
这一看似矛盾的发现——突变对非- - -有害器官移植患者可能是由DNMT3A在细胞内的作用所解释的。在其他方面健康的人身上,DNMT3A突变与免疫系统活性增加和炎症有关,炎症会增加心脏病和中风等疾病的风险。林德斯利解释说,相比之下,在干细胞移植中,增强的免疫活性正是杀死受体癌细胞所需要的。
在这项研究中,没有一个DNMT3A或TET2基因突变的移植受者从供体细胞中患上白血病。在8名出现供体细胞白血病的患者中,有7名患者接受了来自患有CH的供体的细胞,这些供体的干细胞存在罕见突变,比如TP53基因突变,或者携带DDX41基因遗传突变。
“克隆造血是一种异质状态——在不同的个体中采取各种不同的形式。伴有DNMT3A突变的CH不应该成为排除捐赠者的理由,因为我们没有发现他们的不良影响,而是发现了有益的影响,”Lindsley说。
Lindsley继续说,DNMT3A突变的移植受者通常有更高的存活率,这一发现也可能导致干细胞移植领域之外更好的治疗。通过将免疫疗法与靶向DNMT3A的药物相结合,医生可能能够动员一种特别有效的免疫系统攻击肿瘤细胞。
更多信息:Christopher J. Gibson等,供体克隆造血与移植后受体结局,临床肿瘤学杂志(2021)。DOI: 10.1200 / JCO.21.02286