科学家确认了一种基因在胎盘发育中的重要作用
在法国国家心血管研究中心(CNIC),科学家利用实验小鼠模型确定了基因GPR126在妊娠期胎盘发育中的重要作用。
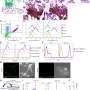
研究结果发表在科学的进步,表明GPR126(粘附G蛋白偶联受体126)是重要的发展一种特殊的胎盘细胞类型,它调节子宫血管的重塑。小鼠Gpr126突变体的心脏缺陷继发于胎盘缺陷,反映了胎盘和心脏缺陷之间的密切关系胎儿心脏.
有证据表明GPR126可能在人类的胎盘发育中起着类似的作用。携带GPR126基因突变的妇女的婴儿会在妊娠期间或出生后不久死亡,这些妇女中30%会发展成子痫前期。这种妊娠并发症影响到一般人群中5 - 8%的妊娠,其特征是高血压这会损害母亲和胎儿,并可能导致胎儿死亡。
动物模型实验表明,GPR126对于周围神经系统(PNS)的成熟、骨骼和软骨的形成以及内耳的发育都是必需的。在人类中,GPR126的突变与骨骼畸形和四肢肌肉痉挛有关。
由José Luis de la Pompa博士领导的CNIC细胞间信号通路在心血管发展和疾病研究小组最初确定GPR126是在心血管发育过程中受NOTCH信号通路(动物高度保守的细胞间信号系统)调控的基因心发展。
提示GPR126可能影响发育中的心脏心肌细胞的增殖和分化。
其他研究小组已经提出在小鼠和斑马鱼的心脏发育中需要GPR126,但研究还没有提供确凿的证据来证实这一假设。
在发表于科学的进步在美国,CNIC团队使用遗传技术证明GPR126对小鼠心脏发育不是必需的,但在胎盘的形成中起着重要作用,这一过程被称为胎盘形成。
在解释研究结果时,德拉庞帕博士说:“我们观察到,小鼠体内GPR126的全身失活导致心壁变薄,并导致胚胎死亡。然而,当我们灭活心脏中的特定基因时,胚胎发育不受影响,心脏功能也没有改变。”
研究人员还发现,全身GPR126缺失的致命效应“并没有被心脏中GPR126的特异性重表达所逆转,这表明突变体的胚胎死亡不是由于心脏发育缺陷造成的,”第一作者雷贝卡·托雷格罗萨解释说。
对斑马鱼模型的进一步研究证实,GPR126“与心脏发育无关”。
胚胎发育
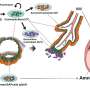
在胚胎发育过程中,GPR126在巨大滋养细胞中表达,这是一种胎盘特有的细胞类型。“这些细胞,”德拉庞帕指出,“对于胚胎的植入和妊娠的维持至关重要。”
研究小组证明,如果胎盘至少保留一个正常的GPR126基因拷贝,胚胎中的GPR126失活与存活是相容的。然而,胚胎和胎盘中的基因失活会导致胚胎死亡。
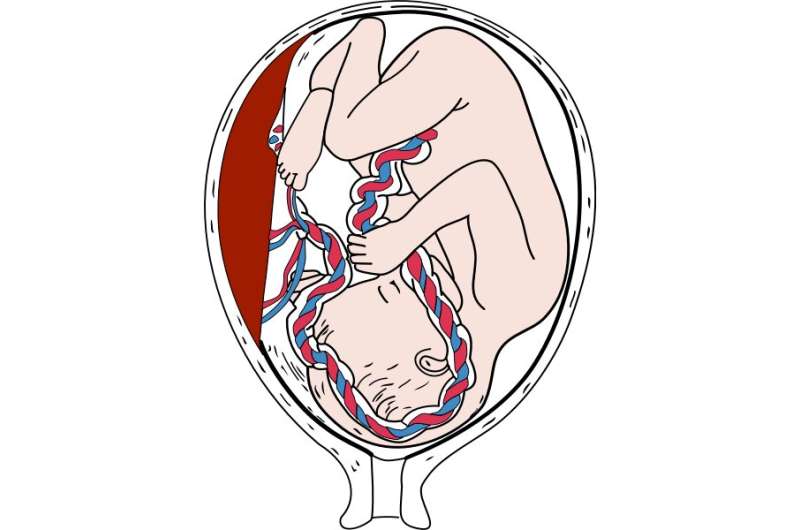
“胎盘发育的关键步骤之一是母体动脉的重塑。这些血管被称为螺旋动脉,它们增大直径以增加流向胚胎的血液。这一过程的缺陷与妊娠并发症有关,如子痫前期,胎儿生长受限,甚至流产,”José Luis de la Pompa说。
研究表明,滋养细胞GPR126是参与螺旋动脉重塑的特定蛋白酶的表达所必需的,而螺旋动脉重塑对胎儿的生存能力至关重要。
基于这些结果,研究人员预示缺乏GPR126的小鼠可作为研究螺旋动脉重塑和子痫前期的实验模型。这动物模型在胚胎植入前遗传学诊断方面具有潜在的临床应用价值。
进一步探索