FDA批准重症肌无力的一级治疗方法

(HealthDay)美国食品和药物管理局周五晚间宣布,vyvgart (efgartigimod),一种新生儿Fc受体阻滞剂(FcRn),被批准用于治疗抗乙酰胆碱受体(AChR)抗体检测呈阳性的成人广泛性重症肌无力。
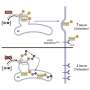
作为一类新型药物的一部分,Vyvgart是一种抗体片段,它与FcRn结合,防止FcRn将免疫球蛋白G (IgG)循环回血液。Vyvgart治疗会降低IgG的总体水平,包括出现在重症肌无力.
批准是基于适应症3期试验(26周)的数据临床研究167名重症肌无力患者被随机分配接受Vyvgart或安慰剂。基于重症肌无力-日常生活活动(MG-ADL)量表的评估,68%的有抗体的重症肌无力患者对Vyvgart有反应,而接受安慰剂的只有30%。在第一个治疗周期中,应答者被定义为MG-ADL量表至少下降2点,持续4周或更长时间。与接受安慰剂的患者相比,接受Vyvgart治疗的患者在重症肌无力定量量表上也有更多反应(63%比14%)。
最常见的副作用包括呼吸道感染头痛,以及尿路感染.使用Vyvgart可能会增加感染的风险,因为IgG水平降低。有报道称出现了过敏反应,包括眼睑肿胀,呼吸急促(气促),和鲁莽;在过敏反应的情况下,FDA注意到应该停止输液并开始适当的治疗。
批准了argenx BV。
版权所有©2021每日健康.版权所有。