机制确定为糖基化的罕见疾病
格林伍德遗传中心(GGC)研究人员报告的发现机制,有助于组织表型PMM2-CDG,先天性疾病的最常见的糖基化(cdg)。
cdg是一组超过130罕见的遗传疾病缺陷引起的脂质和蛋白质的糖基化。表型变量,但往往影响多个身体系统和涉及神经系统功能。PMM2-CDG患者通常显示张力减退、发育迟缓和智力障碍、生长延迟,运动异常,骨骼异常。
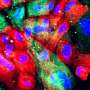
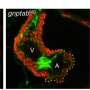
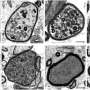
使用斑马鱼模型的PMM2-CDG, GGC Heather Flanagan-Steet博士和她的团队合作者发现缺陷的处理N-cadherin,蛋白质,帮助控制细胞粘附,负责PMM2-CDG颅面和运动性异常。
“一半的蛋白质在人体内的糖基化的,所以很难从力学上看探针的异质群体障碍,“Flanagan-Steet说,格林伍德的基因功能研究中心主任。“寻找hypoglycosylated蛋白负责这个CDG表型就像找到干草堆的针,但我们的这种疾病的新方法允许我们不仅识别这个罪魁祸首,而且测试治疗干预措施。”
cdg大多数之前的研究已经涉及到分析化学的方法确定糖化蛋白质首先其次是询问他们可能连接到障碍,Flanagan-Steet说他们的自顶向下方法创建一个斑马鱼模型就是加速发现。
“我们研究的表型PMM2-CDG斑马鱼模型,让生物学告诉我们去哪里,”她说。的生物学表型建议可能的途径,可能破坏就是让我们N-cadherin。”
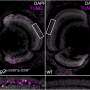
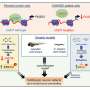
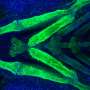
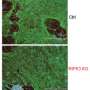
N-cadherin处理允许细胞的粘附性能波动在正常发展。这一过程中断时,往往通过改变控制N-cadherin处理多种蛋白酶的表达,引起PMM2-CDG显形。鱼,这意味着软骨缺陷导致颅面畸形和异常的能动性透过改变游泳行为。
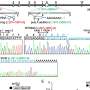
研究人员还发现,通过抑制furin proconvertases,一类的蛋白酶催化N-cadherin处理,多种细胞和分子表型,包括软骨在斑马鱼和颅面缺陷,可以获救。
“通过抑制furin,我们能够改善软骨表型在超过一半的鱼研究表明活动的变化这些proconvertases发起一连串的事件,导致PMM2-CGG的骨骼疾病,“Flanagan-Steet说。“这令人兴奋的结果表明未来的研究可能的治疗干预的节点,最重要的是为世界各地的家庭提供了希望一直影响这罕见的疾病。”
”这种类型的发现代表一个重要的下一阶段CDG research-unraveling难以捉摸的这些疾病的发病机理发现蛋白质在细胞中异常糖基化的影响,”Richard街头说博士GGC主任研究。“我们也扩大我们的努力与我们的同事确定cdg的遗传修饰符在克莱姆森人类遗传学中心(CHG)。这将提供另一个有前途的途径治疗”。
这项工作是由江森自控的洞察力在乔治亚大学的合作者,桑福德儿童健康研究中心,UT西南医学中心,南卡罗来纳医科大学的。
更多信息:Elsenoor j·克拉弗et al, Protease-dependent N-cadherin缺陷处理驱动PMM2-CDG发病机理,江森自控的洞察力(2021)。DOI: 10.1172 / jci.insight.153474