SARS-CoV-2蛋白与帕金森蛋白相互作用,促进淀粉样蛋白形成
一些相对年轻的COVID-19患者在感染病毒几周内患上了帕金森症,这让科学家们怀疑这两种疾病之间是否存在联系。现在,研究人员报告说ACS的化学神经科学已经表明,至少在试管中,SARS-CoV-2 n蛋白与一种名为α-突触核蛋白的神经元蛋白相互作用,并加速淀粉样原纤维的形成,这种病理蛋白束与帕金森病有关。
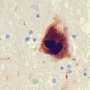
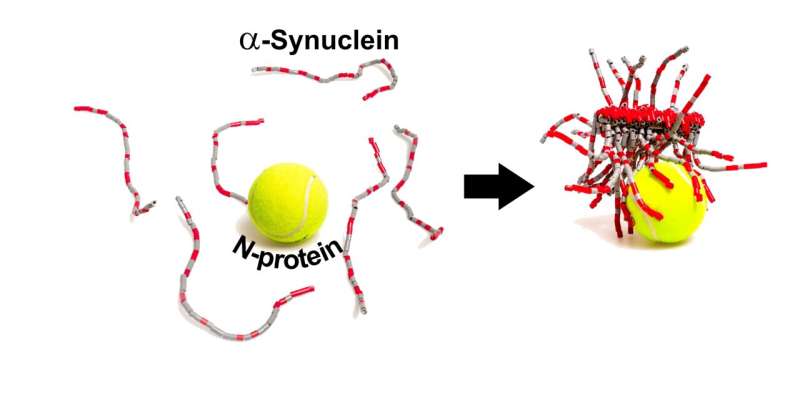
除了呼吸道症状外,SARS-CoV-2还会导致神经系统问题,如嗅觉丧失、头痛和“脑雾”。然而,这些症状是由病毒进入大脑引起的,还是由免疫系统为应对病毒而在大脑中释放的化学信号引起的,仍有争议。在帕金森氏症中蛋白质α-突触核蛋白会形成异常的淀粉样原纤维,导致大脑中产生多巴胺的神经元死亡。有趣的是,嗅觉丧失是帕金森氏症常见的运动前症状。这一事实,以及COVID-19患者中帕金森症的病例报告,使Christian Blum、Mireille Claessens和同事想知道SARS-CoV-2的蛋白质成分是否可以触发α-突触核蛋白聚集成淀粉样蛋白。他们选择研究病毒中最丰富的两种蛋白质:帮助SARS-CoV-2进入细胞的刺突(S-)蛋白,以及封装病毒内部RNA基因组的核衣壳(N-)蛋白。
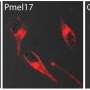
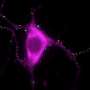
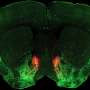
在试管在实验中,研究人员使用了一种结合淀粉样原纤维的荧光探针,结果表明,在没有冠状病毒蛋白的情况下,α-突触核蛋白需要超过240小时才能聚集成原纤维。添加s蛋白没有效果,但n蛋白将聚合时间缩短至24小时以下。在其他实验中,研究小组发现N-和α-突触核蛋白直接相互作用,部分是通过它们相反的静电电荷,每个N-蛋白至少有3-4个α-突触核蛋白的拷贝结合。接下来,研究人员将n蛋白和荧光标记的α-突触核蛋白注射到帕金森病的细胞模型中,使用的n蛋白浓度与sars - cov -2感染细胞内的浓度相似。与只注射α-突触核蛋白的对照细胞相比,注射这两种蛋白后死亡的细胞大约是对照组的两倍。此外,α-突触核蛋白的分布在同时注射了这两种蛋白质的细胞中发生了改变,观察到细长的结构,尽管研究人员不能确认它们是淀粉样蛋白。研究人员表示,目前尚不清楚这些相互作用是否也发生在人类大脑的神经元中,但如果是这样,它们可能有助于解释COVID-19感染和帕金森病之间的可能联系。