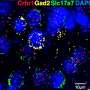
机体在调节性CD4+ T细胞的“浪潮”中对抗感染
每种T细胞都有自己的工作。一个健康的免疫系统会确保没有T细胞越界。
来自拉霍亚免疫学研究所(LJI)的科学家们的一项新研究表明,CD4的一个特殊子集+被称为treg的T细胞在感染早期就开始起作用。treg很重要,因为它们可以防止抗感染的CD8+“杀手”T细胞意外伤害太多的健康细胞。
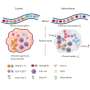
这些早期的treg并不是唯一的treg。通过这项新研究,LJI团队首次展示了两组treg如何在不同的时间通过不同的途径发展。
揭示treg是如何产生的,以及它们究竟是如何起作用的,对于理解人体如何对抗感染至关重要。
“这项工作显示了免疫系统是如何设计出这种非凡的方式来迅速保护宿主免受急性炎症的侵害,”LJI教授斯蒂芬·舍恩伯格博士说,他领导了这项新研究美国国家科学院院刊(PNAS)。
LJI的新研究基于2020年的研究结果细胞的报道研究。Schoenberger实验室之前的这项研究首次展示了人体制造treg的一种全新方式。在这项研究中,研究人员表明,在感染细菌病原体(单核细胞增多性李斯特氏菌),约占CD4细胞的20%至40%+T细胞迅速转化为treg。
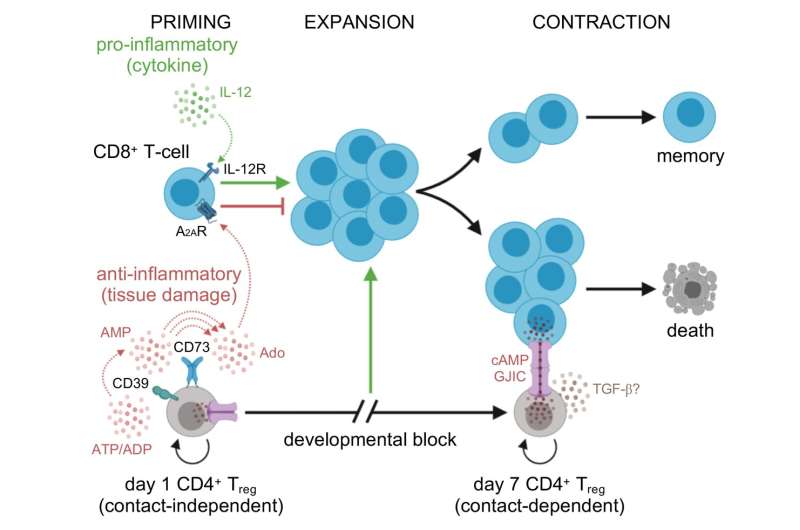
第一类细胞由CD4细胞发育而来+T细胞感觉出了问题。这些转化的treg作为一种快速反应,对形状CD8+ T细胞扩增作出反应,并在感染早期减少对身体自身组织的自身免疫损伤。新PNAS研究表明,这些treg只是对急性感染做出反应的第一波treg。
“文献表明,Tregs在感染早期基本上什么都不做,它们只是在那里关闭免疫反应,”该研究的第一作者约瑟夫·多里纳博士说,他是辉瑞公司的高级科学家,也是舍恩伯格实验室的前成员(辉瑞公司没有披露这项具体研究的财务情况)。“但我们发现有一波早期的Tregs,然后是明显的第二波Tregs。”
在感染的第7天,第二组treg接管。这一波新的treg具有独特的标记,使它们成为一种完全独立的力量,通过与第一波treg不同的途径发展。这些第二波treg是身体产生的一组特殊的treg,用来对付因持续感染而聚集的大量CD8+ T细胞。
“这些树不会变成彼此。Treg种群是异质的,这意味着第一波和第二波代表不同的种群,并且有独立的子集来完成特定的工作,”Dolina说。
研究人员发现,第二波treg可能需要一些时间才能到达感染部位,因为它们的目标不是控制炎症。相反,当需要关闭整个CD8+ T细胞反应时,这些treg就会出现,这表明感染已经被清除。
这些发现可能要归功于日本大阪的Repertoire Genesis公司的研究合作者进行的T细胞受体测序(TCR-Seq)。这种测序方法使科学家们能够追踪treg基因在一段时间内是如何发展的李斯特菌感染。事实上,科学家们可以长期跟踪一个单一的Treg克隆,看看它是否扩展成更多的Treg,消失或停止发育。
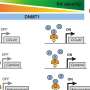
当他们比较两个Treg子集时,研究人员注意到一个有趣的现象:这些组是如何处理腺苷的。腺苷是一种核苷酸,通常被安全地藏在细胞内。当病原体攻击时,细胞死亡,DNA中发现的腺苷就在残骸中。
早期treg将逃逸的dna衍生的腺苷视为一种“危险”信号,并且treg试图利用它来获得优势。它们聚集其他分子,自己制造小的腺苷云,与CD8+ T细胞上的受体结合。这阻断了CD8+ T细胞的反应,减缓了这些CD8+扩展和损害健康组织的能力。相比之下,当CD8+ T细胞反应已经消退时,后一波treg到达。相反,这些treg产生并储存一种来自腺苷的强效调节分子cAMP,并将其直接传递给附近的CD8+ T细胞。
Tregs和CD8+ T细胞之间的舞蹈是复杂的。Treg群体不同的一个原因似乎是在感染过程中维持杀伤细胞和调节细胞的健康平衡。
舍恩伯格解释说:“treg和CD8+ T细胞之间的权衡并不像一个开关。“相反,我们的研究显示了加速和减缓免疫反应的不同途径。”
展望未来,研究人员希望调查不同的treg在身体的哪里度过它们的时间。“我们需要观察它们与CD8+ T细胞的关系,”Dolina说。研究小组还想了解Treg活性如何受到抗原呈递细胞(如树突状细胞)的影响细胞和巨噬细胞。
该研究的其他作者说:“发育不同的CD4+ Treg谱系塑造了CD8+ t细胞对急性李斯特菌的反应感染包括乔伊·李、尤金·l·摩尔、詹妮弗·l·霍普、唐纳德·t·格雷西亚斯、松谷隆二、阿舒·舒拉、杰森·a·格林鲍姆和乔尔·林登。