分子网络可以解释种族差异在三阴性乳腺癌死亡
在两个不同的活动分子网络可以帮助解释为什么三阴性乳腺癌往往是更积极的在非洲裔美国人(AA)妇女与美国白人(WA)妇女相比,由约翰霍普金斯大学一项新研究Kimmel癌症中心研究人员建议。
12月20日在网上发表的调查结果eLife,或许可以解释种族差异在乳腺癌的死亡率的子集癌症为治疗这种致命的疾病和提供新的策略。
“乳腺癌的发病率在非洲裔美国人女性低于美国白人女性,但死亡率更高。我们的工作显示了分子机制导致癌细胞的生长和扩散速度在非裔美国妇女,”研究负责人人员Dipali Sharma博士说,肿瘤学教授约翰·霍普金斯大学医学院和约翰补炉乳腺癌预防基金会研究员。
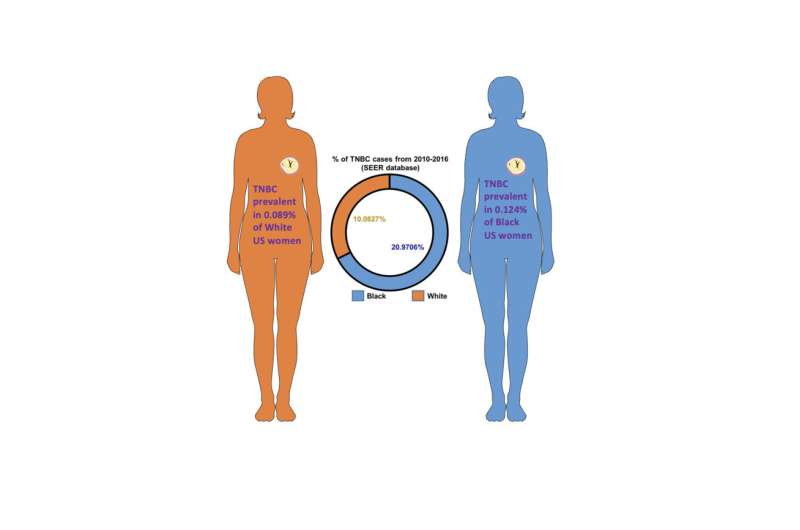
更好的诊断和治疗乳腺癌死亡率下降在过去的几十年里,死亡率减少了40%,但42% AA妇女仍然比佤族妇女更有可能死于这种疾病。虽然AA女性乳腺癌发病率低于佤族女性总体而言,死亡率的差距可以部分解释为AA三阴性乳腺癌的女性的发生率更高,咄咄逼人的乳腺癌的特征子集缺乏雌激素,孕激素和HER2受体。然而,即使在三阴性乳腺癌,AA的女性倾向于更积极比佤族妇女,显著减少AA存活率。
为了更好地理解这一现象,沙玛和她的同事们相比三阴性乳腺癌的行为细胞系孤立的从AA和佤族妇女。当生长在培养皿,细胞从AA女性增加速度,更有侵入周围组织,更容易迁移,有更多的“干细胞”细胞能够创造新的肿瘤与细胞从佤族女性。放入老鼠时,细胞从AA女性创造了更大的肿瘤和转移更快速度要快于佤族女性的细胞。
“三阴性乳腺癌癌症细胞从非裔美国女性更积极的从一开始,“说苏米特哈斯,第一作者在纸上和约翰霍普金斯医学博士后。
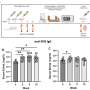
寻找分子机制这些差异背后,研究者评估基因活性在每个细胞系和肿瘤样本AA和佤族妇女。他们发现两种基因,称为GLI1 Notch1,细胞更活跃在隔绝AA女性与隔绝佤族女性。两个基因产生的蛋白质被称为转录因子Sheetal Parida解释说,该研究的共同作者和博士后,负责调节其他基因的大型网络可以广泛影响细胞的功能。
确定GLI1 Notch1可以作为有效的目标三阴性乳腺癌,研究者给细胞系来自佤邦和AA抑制剂的女性的这两个基因与一个共同的化疗剂用于治疗这些癌症。虽然每个代理在很大程度上是无效的,结合这三个药物显著地抑制生长,AA细胞系的入侵和迁移。治疗小鼠肿瘤生长从这些细胞系有类似的积极作用,减少肿瘤大小和转移。
Sharma说,她和她的团队计划继续测试GLI1和Notch1抑制剂三阴性乳腺癌的老鼠模型,找到最好的结合化疗,最终调查这一策略在临床试验的患者这种疾病亚型。
“最后,”她说,“我们可能会关闭非洲裔美国人和美国白人女性生存差距三阴性乳腺癌。”