再生所需的特殊肝脏血管识别因子
威尔康奈尔医学院的研究人员发现了一种关键蛋白质,可以诱导肝脏血管的特化。这一发现可能会导致设计替代肝组织来治疗常见的肝脏疾病。
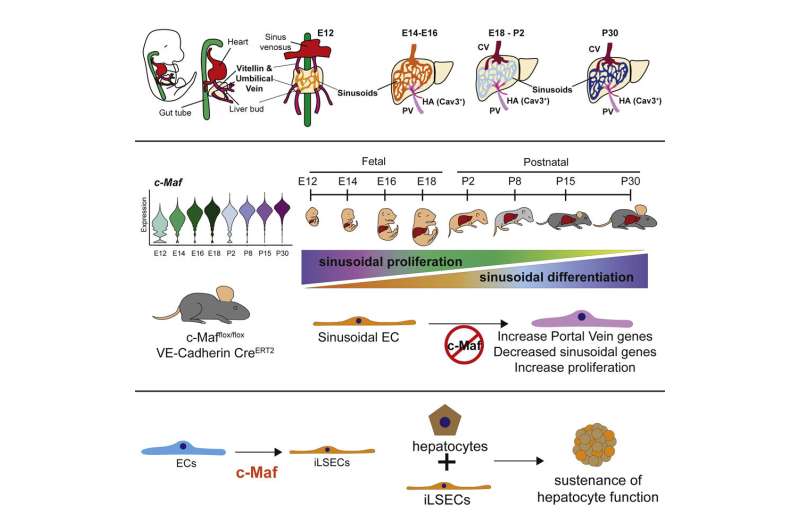
血管有很多种人体它们在功能上是不同的。在肝脏中,这些血管被组织成由“邮政编码”标记的不同区域,这些区域由特定蛋白质的表达指定。正弦内皮细胞形成一种特殊的肝脏小血管类型,通过与肝细胞(肝脏中的主要细胞类型)的相互作用,协调控制炎症和免疫反应、解毒化学物质和产生血液凝固的关键蛋白质等关键任务。这些独特的血管也会分泌生长因子驱动肝再生,从而保护肝脏免受损害和损伤,例如过度饮酒病毒性肝炎或高脂肪饮食。
这项研究于3月31日发表于细胞干细胞研究人员发现,一种名为c- mafa的蛋白质——一种控制大量基因的转录因子类蛋白质的成员——是幼稚内皮细胞特异性成熟为肝窦血管所必需的。研究人员用这种蛋白质从其他细胞中制造出正弦细胞人内皮细胞并表明这些诱导的正弦细胞可以帮助维持肝细胞的健康。
“这些发现将为临床前试验奠定基础,在临床前试验中,永久受损的血管可以用健康的工程肝窦细胞替代,以加速再生和修复,”该研究的共同高级作者Shahin Rafii博士说,他是再生医学部主任,Ansary干细胞研究所所长,Weill Cornell医学遗传医学的Arthur B. Belfer教授。新成立的哈特曼治疗性器官再生研究所(Hartman Institute for Therapeutic Organ Regeneration)将是进一步探索这项研究的医学意义的关键。
根据美国疾病控制和预防中心的数据,慢性肝病每年至少影响数百万美国成年人,导致约5万人死亡。最常见的肝病包括酒精性肝硬化、非酒精性脂肪肝以及乙型和丙型肝炎病毒感染。所有这些都涉及导致纤维化的炎症过程,在这个过程中,健康的组织逐渐受损,并被纤维化的疤痕样组织所取代,从而损害肝脏的功能。
晚期肝病和纤维化目前是无法治愈的肝脏移植手术威尔康奈尔医学消化病学和肝病科医学副教授、联合资深作者罗伯特·施瓦茨博士说:“这是一种昂贵且具有手术挑战性的选择,并非所有患者都适合,由于缺乏合适的捐赠肝脏,往往无法及时安排。”“因此,开发新疗法的需求还没有得到满足,比如构建迷你肝脏来治疗这些终末期疾病。”
先前的研究表明,肝脏中的窦内皮细胞和其他血管内皮细胞可以帮助器官抵抗纤维化,甚至在损伤后部分自我再生。这反过来又暗示了人工制造这些细胞作为肝脏疾病的细胞疗法的可能性。然而,要做到这一点,生物学家需要更多地了解这些细胞是如何在肝脏中自然发育的。
在这项新研究中,研究人员追踪了胚胎小鼠和新生小鼠肝脏中数万个单个内皮细胞的基因活性,显示了不同类型的肝内皮细胞是如何从未成熟的祖细胞中产生的。
“这项综合分析揭示了转录因子c-Maf作为一个关键开关,控制正弦内皮细胞成熟和规范为高度独特的血管,是定制的,以支持肝细胞的日常需求和功能,”研究第一作者Jesus Maria博士Gómez-Salinero说,他是Rafii实验室的医学讲师。“当我们在内皮细胞中特异性地删除c-Maf时,这导致了窦状血管发育中断,使小鼠肝脏在损伤后更容易纤维化。”
相比之下,强迫人类版本的c-Maf在非特化的人类内皮细胞中变得活跃,导致这些细胞发展出肝窦内皮细胞的独特标记。研究人员将这些细胞称为“诱导肝窦内皮细胞”(iLSECs)。利用复杂的生物信息学分析由一组计算生物学家,博士。威尔康奈尔医学院的Franco Izzo、Dan Landau和David Redmond透露,iLSECs已经获得了支持性原生肝窦血管的大部分特征。值得注意的是,这些iLSECs支持肝细胞,使它们长期保持健康和功能,否则它们将在培养皿中死亡。
研究人员正在继续研究这些潜在的治疗细胞如何在肝脏中发育,以及如何在实验室中最好地诱导它们构建肝组织。他们指出,虽然使用iLSECs作为注射或输注细胞疗法来治疗病变肝脏是一种可能的策略,但另一种方法是开发增加天然肝窦内皮细胞数量的药物,例如通过增加肝脏中的c-Maf活性。或者,iLSECs将来可以在实验室中用于构建血管化的肝小器官来替代受损的肝脏,这是一种潜在的治疗方法,可以治疗数千名绝望地等待肝脏捐赠者进行肝移植的患者。