从一种微小的蠕虫身上,我们得到了转移性癌细胞如何推动其致命扩散的新线索
入侵的军队需要稳定的燃料和武器供应。当入侵者是细胞时也是如此,比如当肿瘤细胞脱离它们的邻居,在一个被称为转移的过程中扩散到身体的其他部位——这是癌症最致命的部分。
现在,杜克大学领导的一项关于小型线虫线虫的研究为入侵细胞如何聚集并在入侵前线部署燃料以驱动它们的细胞突破机制提供了新的见解。
在杂志上的一项研究中细胞发育杜克大学生物学教授舍伍德(David Sherwood)和他的同事们已经发现了两种葡萄糖转运蛋白,当它们失去活性时,会破坏葡萄糖的代谢能源供应阻止蠕虫细胞的入侵,甚至阻止其中的一些。
这一发现可能最终会带来切断癌细胞在人体转移的补给线的新方法。
Sherwood说:“这是一件大事,因为它为我们提供了一个新的侵袭性细胞的治疗目标。”
转移性癌症是出了名的难以治疗。大多数抗癌药物都是通过破坏作用起作用的肿瘤细胞或者减缓他们的增长。但两百多人中很少有人抗癌药物已经被批准了临床使用实际上可以防止癌症从原始肿瘤上脱落并扩散到其他器官——这是绝大多数癌症相关死亡的罪魁祸首。
该论文的资深作者Sherwood说:“我们没有针对这一步的治疗方法,因为我们对细胞如何突破组织屏障没有很好的了解。”“这很讽刺,因为这是癌症最致命的一面,但却是我们了解得最少的一面。”
部分原因是这个过程很难研究。癌症的扩散是不可预测的,大多数癌细胞转移到体内深处,超出了光学显微镜的观察范围。
“很难当场发现侵入性细胞,”舍伍德说。
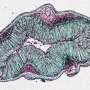
因此,舍伍德的实验室在名为秀丽隐杆线虫的毫米长透明蠕虫中研究了类似的过程。在发育中的蠕虫完成其生殖道的构建之前,一种叫做“锚细胞”的特殊细胞必须冲破分隔蠕虫子宫和外阴的致密的片状网状结构,为交配和产卵扫清道路。
蠕虫细胞和人类癌细胞都使用相同的侵入机制:从细胞中喷出的一连串活塞状突起细胞表面它们会冲破组织屏障,为细胞清除一条通道,就像冲出逃生通道一样。
“问题是,‘这些机器的动力是什么?’”第一作者、杜克大学细胞生物学博士生Aastha Garde说。“我们能不能把目标锁定在人类身上,而不是机器本身,剥夺它们的能量来源,让机器停止工作?”
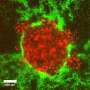
研究人员使用一个连接在高倍显微镜上的摄像机来观察比沙粒小数百倍的蠕虫细胞内部,并观察它们的“入侵”过程。
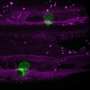
加德展示了一个入侵细胞的延时镜头,当它推入邻近的组织时。这种细胞设计了一个传感器,当一种名为ATP的携带能量的分子达到一定水平时,传感器就会亮起,就像细胞燃料计一样。就在细胞即将突破的时候,一束光出现在细胞前线的后面,揭示了ATP在突破时的涌出。
研究人员发现,这种ATP是由一种叫做线粒体的细胞器产生的,线粒体是细胞的能量工厂,它被一种叫做网蛋白的分子线索引导到细胞的入侵前线。
研究人员还对这种蠕虫大约2万个基因中的8300个进行了筛选,用一种叫做RNA干扰的技术逐个抑制它们,以观察蠕虫细胞是否仍然能够突破。
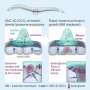
他们发现了两个编码门状蛋白质的基因,称为FGT-1和FGT-2。在侵入细胞之前,这些细胞会沿着细胞边界聚集,并让更多的葡萄糖进入细胞,在那里葡萄糖被分解生成ATP。
当研究人员使这些基因失活时,葡萄糖和ATP水平下降,蠕虫细胞停止了传播。通过显微镜,他们可以看到细胞微弱地努力吐出新的活塞状突起,以推进,但大多数都被延迟了,三分之一的细胞完全停止了前进。
“没有葡萄糖,锚细胞用来穿透基底膜的整个机制基本上都受到了损害,”加德说。
还有很多科学家还不知道是什么造成了癌症细胞转移。但是研究人员希望他们对蠕虫的研究能帮助他们“找到细胞入侵的阿喀琉斯之踵,”舍伍德说。
“这是如何细胞这一漏洞很大程度上被忽视了,”舍伍德说。“如果我们能阻止ATP的爆发,我们就能限制或阻止细胞入侵。”
进一步探索