自闭症在子宫里开始吗?
Toru Takumi教授领导的一个国际研究小组(高级访问科学家,来自生物系统动力学研究中心)和研究员林Chia-wen神户大学研究生院医学表明,特发性自闭症是由表观遗传异常造血细胞在胎儿发育过程中,导致大脑和肠道的免疫失调。研究结果显示,孤独症,有免疫异常,可以看到大脑和肠道。自闭症的病理生理学的进一步分类可能导致新的治疗策略的创建自闭症和其他神经发育障碍。这项研究结果将发表在《分子精神病学》2022年5月2日,星期一。
研究背景
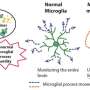
孤独症谱系障碍是一种发育神经系统紊乱,基本上仍是无人尽管的患者数量迅速增加。免疫异常,现在被认为是许多疾病的原因,在的发展也起着重要的作用自闭症。脑部炎症和扰动的外围自闭症患者的免疫系统经常被观察到。此外,免疫异常在肠道菌群异常的陪同下,也被认为是参与疾病的发病机理通过brain-gut轴。然而,这些免疫异常背后的基本机制尚未阐明。
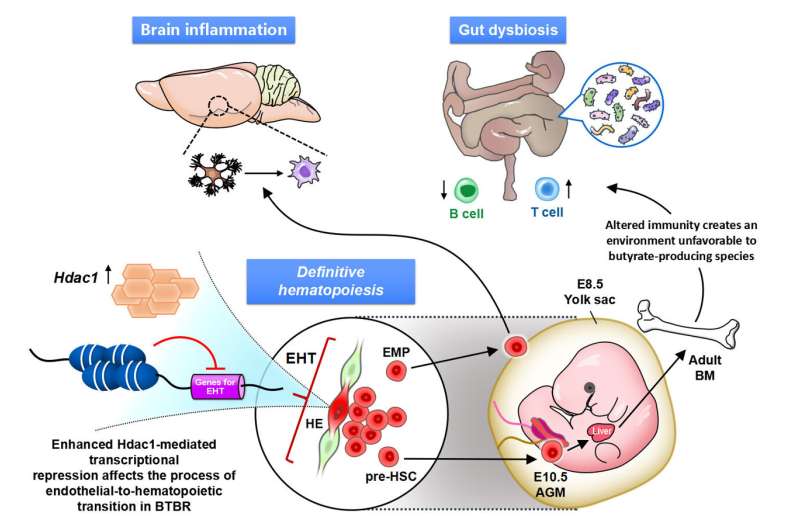
鉴于免疫的关键发展阶段的侮辱和广泛参与免疫系统发展的自闭症,研究小组推测,一个常见的病因基础广泛的免疫失调和源自不同类型的祖细胞。分析关注造血细胞免疫细胞来源于以及卵黄囊(y)和aorta-gonad-mesonephros (AGM),在胎儿阶段参与造血作用。这些结果寻求一个共同祖先的脑部炎症和外围的免疫系统异常。在这项研究中,BTBR老鼠作为特发性模型用于自闭症。
研究发现
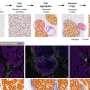
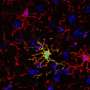
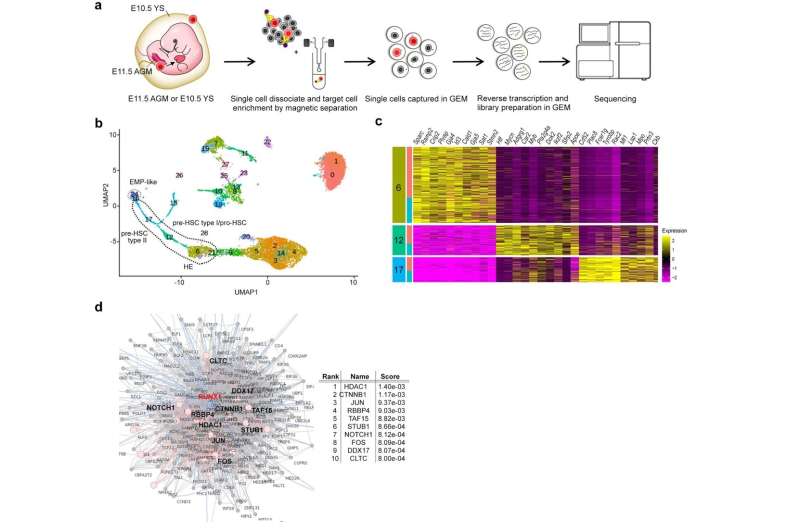
单细胞RNA序列(sc-RNA seq) BTBR老鼠将免疫异常的起源追溯到胚胎阶段的卵黄囊和aorta-gonad-mesonephros (AGM)和识别巨噬细胞(小胶质细胞)和外周免疫细胞分化。明确的造血作用在y和AGM单细胞水平在分子水平上分析成功地确定了病理机制内罕见的祖细胞在开发的早期阶段。也就是,我们找到了一个通过HDAC1常见的转录调控机制,组蛋白脱乙酰酶,潜在的这些病态(图1和图2)。
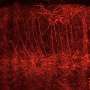
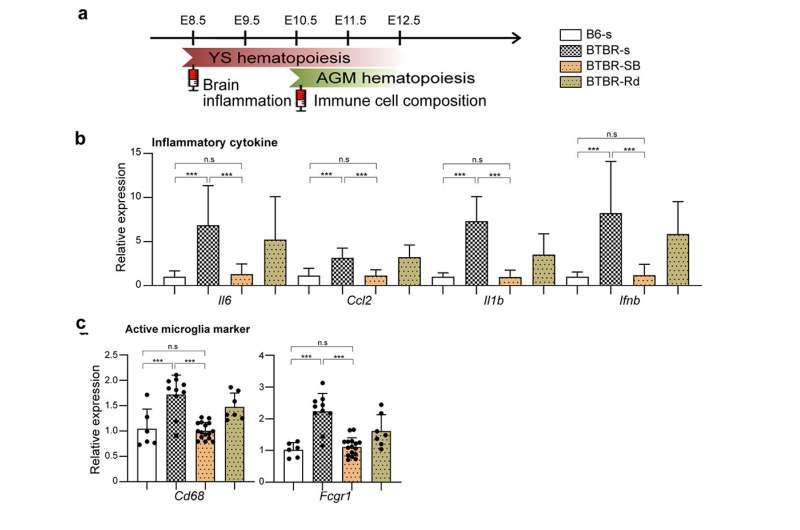
我们还表明,操纵表观遗传机制在特定的发展阶段可以恢复免疫异常在大脑和外围组织。也就是,我们确定了组蛋白脱乙酰酶HDAC1作为常见的机制。管理这组蛋白抑制剂(丁酸钠或Romidepsin)在胎儿阶段BTBR老鼠抑制炎性细胞因子升高和小胶质激活(图3)。
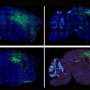
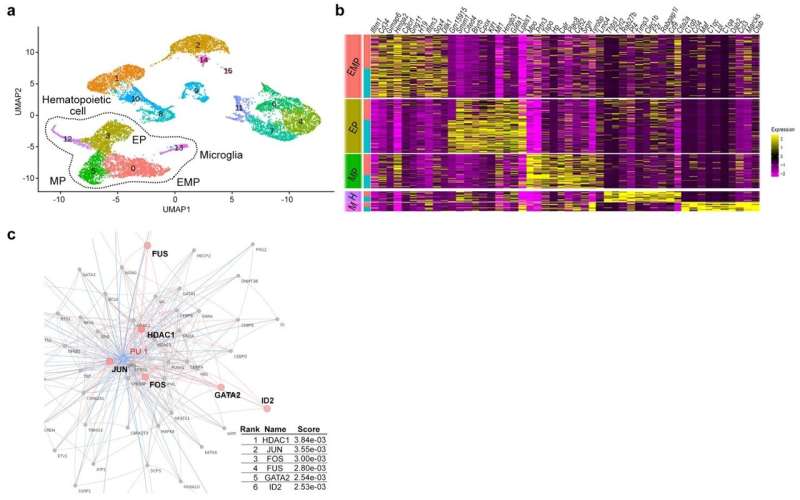
我们进一步证明免疫特异表达可以确定肠道失调的特定配置文件在自闭症模型小鼠,使Treg的潜在生物标志物和肠道失调immune-dysregulated ASD亚型分类的一种手段。从上面的,很明显,大脑中的异常和周边器官(如肠道)出现在自闭症是由表观遗传异常引起的造血干细胞谱系,的祖先免疫细胞(图4)。
视角
我们的发现不仅提供缺失的拼图来解决长期的系统性免疫失调在自闭症,而且提示表观遗传障碍常见病因的作用在不同的孤独症环境风险因素的模型。此外,为将来ASD,开发精密医学ASD子类型化根据发病机制是一个关键的第一步解决ASD的异质性和为自闭症的治疗开辟一条新途径。
更多信息:林Chia-Wen et al,常见的表观遗传机制在不同的细胞起源构成系统性免疫失调的特发性自闭症小鼠模型,《分子精神病学》(2022)。DOI: 10.1038 / s41380 - 022 - 01566 - y