肠道菌群通过保持免疫系统的警觉来防止病毒感染
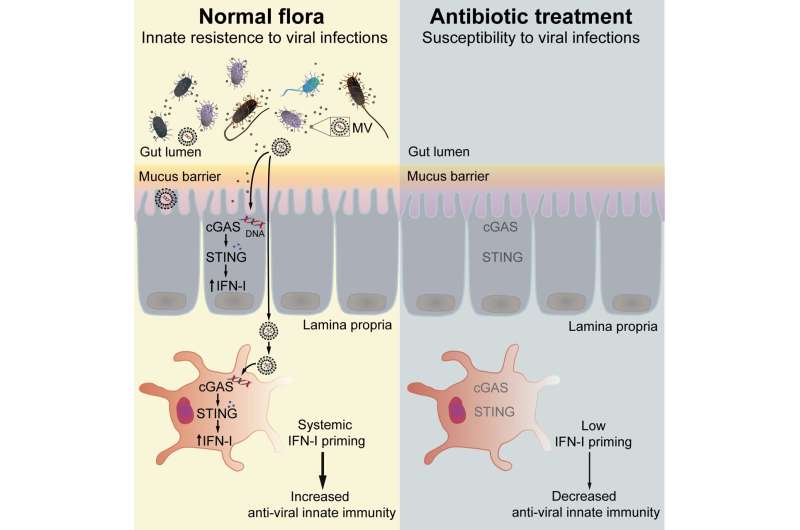
微生物群是健康的基础。但是,这些非侵入性微生物是如何与身体的其他部分沟通,从而影响宿主生理的,目前还不完全清楚。来自斯德哥尔摩、Umeå和瑞典哥德堡大学的研究人员报告了肠道菌群如何对病毒感染的自然抵抗力至关重要。他们表明,肠道菌群中膜囊泡的释放导致了细菌DNA的系统性传递到宿主细胞。这触发了细胞质cGAS-STING-IFN-I轴,用于先天免疫DNA感知,从而保护远端器官免受病毒感染。这项研究发表在杂志上免疫力.
所有多细胞生物的表面都不断地充斥着共生微生物,也被称为微生物群,它们影响着许多宿主的生理过程。其中绝大多数是居住在肠道内的胞外细菌。这些微生物对免疫系统的发育和成熟至关重要。它们还可以防止细菌和细菌真菌病原体通过在营养或附着位置上与它们竞争,并生产抗菌物质。但是这些肠道腔内的非侵入性细菌是如何介导系统免疫调节的以及它们对病毒感染还没有完全理解。
“我们对肠道细菌对病毒感染的影响很感兴趣。因此,我们用抗生素治疗小鼠,然后用两种不同类型的病毒感染它们——一种是DNA病毒,一种是单纯疱疹病毒1型(HSV-1),另一种是RNA病毒,水疱性口炎病毒(VSV)。我们发现,抗生素治疗使小鼠更容易感染这些病毒,这是由于被称为I型干扰素(IFN-Is)的抗病毒免疫分子的基础表达减少,”Umeå大学的Saskia Erttmann博士说,他是该研究的第一作者。
免疫系统通过几个天然受体家族来检测微生物。这些包括细胞表面定位toll样受体(TLRs),调查细胞外环境和细胞质受体,如循环GMP-AMP合成酶(cGAS),警报免疫系统细胞内存在外来或错位的DNA。cGAS在检测到DNA后,合成循环GMP-AMP (cGAMP), cGAMP通过干扰素基因刺激器(STING)发出信号,诱导IFN-Is的表达。
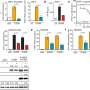
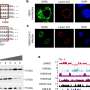
为了了解微生物群如何诱导IFN-Is的基础表达,作者分析了不同先天免疫通路缺陷的小鼠。他们发现,通过菌群诱导IFN-Is涉及到cGAS-STING通路的紧张性激活,而这并不需要细菌-宿主细胞的直接接触。因此,cgas - sting通路被切除的小鼠对HSV-1和VSV感染的反应更弱,更容易受到感染。
细胞外微生物(包括肠道菌群)的先天免疫感应通常被认为是通过细胞表面而细胞质免疫受体(如cGAS)的激活只发生在对侵入性DNA病毒、致病菌或携带毒力因子的寄生虫的反应中,这些毒力因子允许它们入侵并在细胞内复制。因此,细胞内cGAS-STING通路是细胞外肠道细菌的传感器的发现是出乎意料的。此外,我们还不清楚肠道细菌是如何被粘液和肠道上皮层等屏障从宿主细胞中分离出来的,但仍然能够触发系统性的cgas -螫- ifn - i反应,保护远端器官免受病毒的侵害,”斯德哥尔摩大学的Nelson Gekara博士解释说,他是该研究的高级研究员。
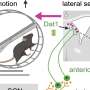
细菌膜囊泡(MVs)是细菌释放的小脂质双分子层囊泡,可以穿过组织和细胞膜屏障。因此,研究人员认为mv是可能的载体,允许肠道细菌将DNA运送到遥远的宿主细胞,从而介导系统的cGAS-STING-IFN-I反应。事实上,他们发现含有来自肠道菌群的膜泡的DNA存在于血液循环当与体外细胞一起孵育或接种到小鼠体内时,这种mv促进了病毒的清除。
“这项研究填补了我们理解的一个重要空白肠道微生物群介导系统免疫调节。它们还强调了抗生素被低估的风险:抗生素通常由自我用药的患者服用,以“治疗”未确诊的疾病,有时也被开给患者,以预防病毒感染后经常出现的细菌感染。我们的结果表明,通过扰动微生物群在美国,抗生素会损害我们对抗病毒感染的能力。在当前全球病毒大流行的时代,一个相关的、或许是及时的信息是,过度使用抗生素可能加剧病毒感染,”Nelson Gekara博士总结道。
进一步探索