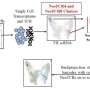
患者来源的微器官球使尖端精准肿瘤学成为可能
患者肿瘤细胞对治疗的反应受多种因素影响,包括基因改变、肿瘤微环境和瘤内异质性。这使得在最近开发的候选药物和癌症疗法数量不断增加的情况下,确定最佳治疗方案变得极其困难。除了这些挑战之外,诊断后必须做出治疗决定的有限时间框架——通常在两周或更短的时间内。
现有致瘤模型的缺陷使其不适用于临床使用.患者来源的肿瘤细胞系在继代培养时发生变化,使其与肿瘤模型不准确,而由异种移植物(患者肿瘤细胞注射到免疫缺陷小鼠)制成的模型保留了它们的特征,但生产费时且昂贵。病人衍生的类器官,微型化的3D版本肿瘤组织失去病人肿瘤微环境在传代培养期间,这些类器官的及时生产用于临床决策仍然是无法实现的。
这些挑战已经在一个多组织的合作努力中得到了解决,其中包括来自Terasaki生物医学创新研究所(TIBI)和杜克大学的科学家,由TIBI的首席科学官和教授沈锡玲博士领导。
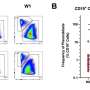
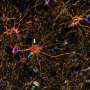
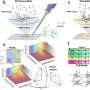
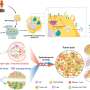
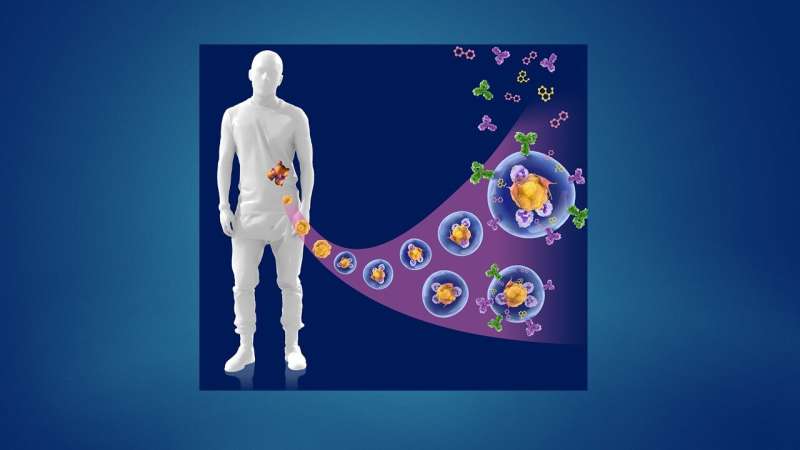
正如他们最近发表在细胞干细胞,该团队开发了一种基于液滴的微流控技术在一小时内从癌症患者的活组织切片中制造出微器官球。病人肿瘤,免疫,还有结缔组织细胞快速形成微型肿瘤,在数千个这些MOS中保留原始微环境,可用于测试许多药物条件。对各种癌变来源的MOS的测试表明细胞的保留遗传资料,以及原发肿瘤组织基因和免疫抑制标志物的表达情况。
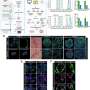
使用来自一小组转移性结直肠癌患者的MOS进行的初始测试与一组候选治疗药物进行了筛选。当将药敏结果与实际临床治疗结果进行比较时,几乎完全相关。更重要的是,MOS可以从少量细胞中产生,就像通常从活组织检查中收集的那样,整个MOS的生成和药物筛选过程只需不到两周的时间。
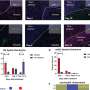
在随后的一系列优雅的实验中,研究人员开发了测试MOS对免疫疗法.他们成功地证明了双特异性抗体动员原始微环境中的常驻免疫细胞攻击肿瘤细胞,这是免疫治疗筛选领域的一项前所未有的成就。在另一系列实验中,科学家们测试了他们的MOS与联合免疫疗法的影响,并能够证明预测的反应和多种治疗方案的优化。
他们还能够观察到被激活的t细胞有效地渗透到MOS,并随后杀死MOS肿瘤细胞;这种t细胞浸润是可以实现的,因为MOS液滴的尺寸小,表面体积比大,可以模拟组织内的自然扩散极限,而使用传统模型无法获得。
研究小组的发现对临床有巨大的影响。在开发癌症治疗模型的过程中遇到了许多困难,他们的工作满足了许多需求。他们从有限的活检组织中及时、低成本地生成准确的肿瘤模型的方法,为药物和免疫疗法的各种测试途径打开了大门。MOS生产的自动化确保了再现性,这是FDA的要求。
“这里开发的技术是固体生理建模的突破性进展肿瘤TIBI的董事兼首席执行官Ali Khademhosseini博士说。“这肯定会对临床产生非常重大的影响。”
更多信息:丁胜利等,患者来源的微生物球使临床精准肿瘤学成为可能,细胞干细胞(2022)。DOI: 10.1016 / j.stem.2022.04.006