研究人员解锁衰老的细胞秘密

新的研究发现了如何在70岁以后血液干细胞中缓慢积累的遗传变化如何缓慢积累。
Wellcome MRC剑桥干细胞研究所和合作者的科学家,惠康桑格研究所的科学家今天发表在《杂志》上自然,并提出了一种新的衰老理论。
全部人类细胞获得遗传变化一生,被称为体细胞突变。衰老可能是由于我们对我们的多种类型损害的积累而引起的细胞随着时间的流逝,一种理论是,体细胞突变的积累会导致细胞逐渐失去功能储备。但是,目前尚不清楚分子损伤的这种逐渐积累如何转化为我们的器官在70岁以后的功能的突然恶化。
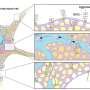
调查这一点老龄化进程,惠康桑格学院的团队,剑桥干细胞研究所和合作者研究了生产血细胞从骨髓中,分析了从新生到老年人的10个个人。他们测序了3,579的整个基因组血干细胞,识别每个细胞中包含的所有体细胞突变。该团队用它来重建每个人的“家谱”血液干细胞,首次展示了对血细胞之间关系以及这些关系如何在人类寿命中发生变化的无偏见。
研究人员发现,这些“家谱”在70岁之后发生了巨大变化。65岁以下的成年人的血细胞产生从20,000至200,000个干细胞,每个干细胞的贡献大致相等。相反,70岁以上的个体的血液产量非常不平等。在每个研究的老年人中,一组减少了一组扩展的干细胞克隆(不到10到20),占所有血液产生的一半。这些高度活跃的干细胞在该人的生活中逐渐扩展,这是由罕见的体细胞突变子集引起的,称为“驱动突变”。
这些发现导致团队提出了一个模型,其中与年龄相关的血液产生变化来自躯体突变,导致“自私”干细胞在老年人中占主导地位。该模型通过稳定的引入驱动突变引起数十年来引起功能改变克隆的增长的模型,解释了70岁以后的戏剧性和不可避免的转变,向血细胞种群的多样性降低。哪个克隆变为人物,随着个人的主导地位,不同因此,该模型还解释了老年人疾病风险和其他特征的变化。第二项研究,也今天发表在自然,探讨不同的单个驱动突变如何影响细胞生长速率。
Addenbrooke医院血液学注册官Emily Mitchell博士,博士Wellcome Sanger Institute的学生和该研究的主要研究人员说:“我们的发现表明,由于积极的选择具有驾驶员突变的更快生长克隆的速度。这些克隆“胜过”较慢的生长。在许多情况下,干细胞水平上的适应性提高可能是有代价的 - 他们产生功能成熟的血细胞的能力受到损害,因此解释了观察到的与年龄相关的血液功能丧失。”
剑桥大学Wellcome-MRC剑桥干细胞研究所的助理教授兼惠康皇家学会的助理教授埃丽莎·劳伦蒂(Elisa Laurenti)博士说,这项研究的联合研究员说:慢性炎症,吸烟,感染和化学疗法会导致具有癌症驱动突变的克隆的早期生长。我们预测这些因素还会导致与衰老相关的血干细胞多样性下降。有些因素可能也可能会减慢此过程。现在,我们有一个令人兴奋的任务,即弄清楚这些新发现的突变如何影响老年人的血液功能,因此我们可以学习如何最大程度地降低疾病风险并促进健康的衰老。”
Wellcome Sanger Institute的癌症,衰老和躯体突变计划负责人彼得·坎贝尔(Peter Campbell)博士,研究高级研究员说:“我们首次表明,在整个生命中稳步积累突变是如何导致的70岁以后,血细胞种群的灾难性和不可避免的变化。该模型的超级令人兴奋的是,它也可能适用于其他器官系统。我们看到这些自私的克隆与驱动程序突变在身体的许多其他组织中随着年龄的增长而扩展 - 我们知道这会增加癌症的风险,但也可能导致与衰老相关的其他功能变化。”
进一步探索