首次阐明一种小蛋白质的结构可能对癫痫和其他疾病患者有帮助
科学家首次在原子水平上揭示了一种蛋白质的结构,这种蛋白质将人体最重要的神经递质之一携带到神经元中。
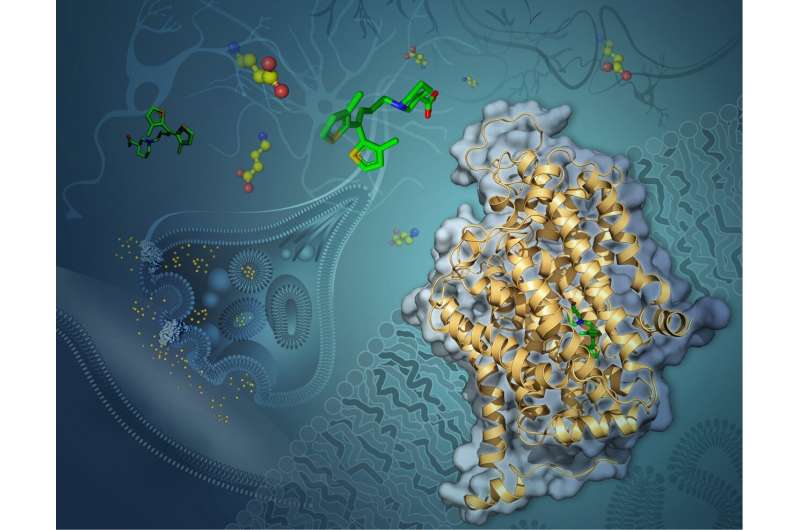
在确定这个转运体的结构时蛋白质-迄今为止解决的最小的蛋白质之一-研究人员开辟了新的途径来改进治疗各种衰弱疾病的药物,包括癫痫,双相情感障碍精神分裂症、帕金森氏症和亨廷顿氏症、焦虑症和自闭症谱系障碍。
这项研究发表在6月8日的杂志上自然.
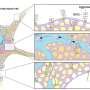
神经元之间通过传递神经递质来传递信号,这种神经递质被称为突触。GABA分子(γ -氨基丁酸的简称)是大脑中最普遍的神经递质之一。
当一个神经元释放GABA时,通过突触向附近的神经元发送,GABA会抑制接收神经元的活动。
但有时情况会出错,没有足够的GABA到达接收神经元,神经元可能会变得过度活跃,发送太多的电脉冲。这可能会导致一些衰弱的影响,包括癫痫。
幸运的是,某些药物可以通过阻断一种叫做GAT-1的蛋白质(GABA转运体1的缩写)来帮助我们。GAT-1负责将释放的GABA回收到释放神经元中。
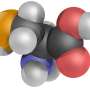
一旦这样的GAT-1抑制剂,tiagabine(商标名Gabitril),减少GABA循环,在突触中留下更多的GABA,以减少接收神经元的活动。
尽管tiagabine可能有效,但它与GAT-1相互作用抑制GABA循环的确切方式一直是一个谜。了解它们之间的相互作用可以帮助研究人员有朝一日制造出更有效的药物。
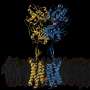
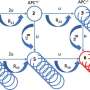
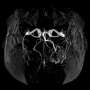
为了解开这个谜团,看看蒂加宾是如何与GAT-1结合的,南加州大学多恩西夫文学、艺术和科学学院的研究人员使用了高度先进的低温电子显微镜,通常被称为冷冻电镜。这项技术包括在极低的温度下冻结分子,接近原子和分子完全停止运动的温度,然后用电子显微镜对它们进行成像。
南加州大学最近在南加州大学迈克尔逊聚合生物科学中心的纳米成像卓越核心中心推出了新的冷冻电镜设备。
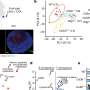
该研究的主要作者Cornelius Gati和USC Dornsife科学家团队观察了GAT-1与tiagabine的复合物,并使用冷冻电镜来观察两者如何相互作用。
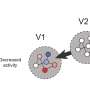
“以前对抑制剂(tiagabine)的理解纯粹基于生化研究,没有提供任何细节原子尺度南加州大学多恩西夫分校生物科学和化学助理教授加蒂说。“我们现在可以确定药物中与蛋白质相互作用的特定部分。”
Gati说,这一新发现表明了一种以前未知的抑制GAT-1的机制,即当tiagabine与GAT-1结合时,蛋白质的整体形状会发生变化。
这项研究揭示的高度详细的信息可以帮助研究人员改进药物或开发新的治疗方法来治疗与gaba控制的神经元相关的疾病。
Gati说:“这些发现对整个药理学有直接的影响,不仅涉及治疗癫痫,而且涉及许多其他疾病。”他补充说,这些结果指出了进一步的研究途径。
“我们有一种感觉,这种新发现的机制比目前认为的要普遍得多,所以我们将首先通过使用结构相似的抑制剂来研究这一点,然后将研究范围扩大到其他分子。”
Gati还指出,使用低温电子显微镜解析相互作用分子的结构被证明是极具挑战性的——gat -1是用该技术解析的最小的蛋白质之一,即使使用如此先进的技术也很难可视化。
他说,他们的成功将激励南加州大学和其他机构的科学家确定其他挑战的结构膜蛋白,从而进一步理解药物-蛋白质相互作用和改进治疗方法。
进一步探索