科学家发现糖尿病的代际“记忆”机制
症状治疗过去一直是慢性疾病的常见方法。例如,通过控制葡萄糖的增加并减轻各种糖尿病引起的胰岛素并发症来治疗糖尿病。但是,如何预防糖尿病在科学和医学界仍然难以捉摸,它已成为一个全球研究热点,以发现该疾病的起源以允许早期干预。
最近,该小组由智格大学医学院妇女医院的Huang Hefeng教授和由中国科学院分子细胞科学中心的Xu Guoliang教授领导的团队,该团队在中国科学院发现了一种新机制糖尿病的代际传播。他们的研究表明,卵母细胞发育中的环境敏感窗口赋予了下一代葡萄糖不耐症的倾向。这些研究结果发表在5月18日的自然。
著名的妇产科医生和妇科医生Huang Hefeng教授对母亲对她后代的潜在影响感兴趣。为此,她带领她的团队对不利的孕产妇环境因素引起的成人后代疾病进行研究。该小组发现,暴露于高葡萄糖/雄激素可能会触发代代相传或跨代遗传慢性疾病通过改变子宫胚胎/胎儿中的DNA甲基化特征,或通过影响精子/卵的表观遗传修饰。黄教授从临床研究和动物模型中得出结论,诸如糖尿病和高血压之类的慢性疾病可能具有发育起源,因此在报告“通过配子的表观遗传遗传”的假设中率先提出了率。尽管如此,该假设仍未得到证实。
为了确认这一假设,黄教授的团队开始关注以下问题:孕产妇的环境因素是否会影响后代的健康?母体高血糖是否会通过卵母细胞增加慢性疾病的风险?
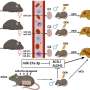
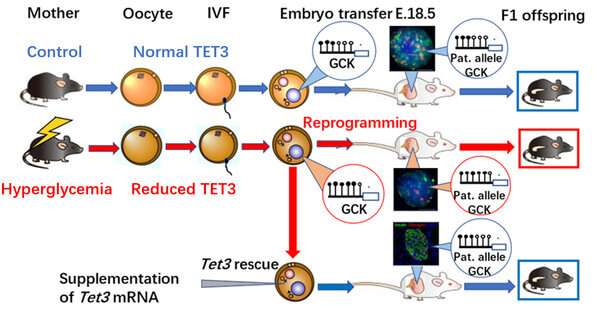
为了解决这些问题,团队建立了女性高血糖老鼠模型。为了排除高血糖对胚胎学和胎儿发育的持续影响,他们巧妙地去除了影响的卵母细胞,以进行体外受精,并将胚胎转移到健康的寄养小鼠中,以产生后代。代谢测量表明,它们的后代表现出受损的葡萄糖耐量,表明卵母细胞受到不良高血糖环境影响的卵母细胞增加了对慢性疾病的敏感性。因此,这一发现支持黄教授的假设。
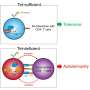
面对这一重大发现,该团队开始怀疑“罪魁祸首”,从而增加了对后代糖尿病的易感性。经过一系列复杂的实验后,他们发现了通过TET3不足供后代的慢性疾病的钥匙 - TET甲基霉素二加氧酶3(TET3)。
Huang Hefeng教授和Xu Guoliang教授的联合研究证实,高血糖雌性小鼠的高葡萄糖环境导致卵母细胞中TET3蛋白的剂量不足,从而导致TET3在Zygote中的重编程能力较差,并最终“脱甲基化的脱甲基化能力“或“高甲基化”。
TET3如何增加后代糖尿病的易感性?葡萄糖激酶基因(GCK)是调节的最重要的蛋白质之一胰岛素分泌。在受精卵的复制和分裂过程中,与胰岛素分泌有关的相关基因的过度甲基化(包括GCK)触发了TET3的轻击潜力。这种TET3不足持续到成年后代。诸如GCK之类的基因的高甲基化和低表达导致胰岛素分泌不足,降低血糖的降低以及随着年龄的增长而增加糖尿病的脆弱性。
这项研究在临床上糖尿病孕妇也得到了证实。临床上未成熟的卵母细胞和丢弃的balstocysts糖尿病患者在杭州和上海的几家医院也接受了GCK启动子区域的TET3表达和高甲基化的降低。这进一步提出了这项研究的临床意义。
“这些研究结果为预防和控制其起源的慢性疾病提供了革命性的见解,这将有助于减少出生缺陷并改善我们人口的健康,”黄教授说。糖尿病高血压通常在家庭中运行,应特别注意由生殖环境引起的跨代遗传。在照顾自己的健康时,我们还应该保护下一代。”
进一步探索