组织模型揭示了肝脏再生的关键作用

人类的肝脏具有惊人的再生能力:即使多达70%的肝脏被切除,剩下的组织也能在几个月内再生出一个完整大小的肝脏。
利用这种再生能力可以为医生提供更多的治疗选择慢性肝病.麻省理工学院的工程师们现在已经朝着这个目标迈进了一步,他们创造了一种新的肝组织模型可以让他们追踪肝脏的相关步骤再生比以前更精确。
该研究团队的负责人桑吉塔·巴蒂亚(Sangeeta Bhatia)说,新模型可以提供无法从老鼠或其他动物身上收集到的信息,因为它们的生物学与人类不一样。
“多年来,人们一直在识别似乎与小鼠肝脏再生有关的不同基因,其中一些基因似乎对人类很重要,但他们从未设法弄清楚使人类肝细胞增殖的所有线索。”Bhatia说,他是麻省理工学院健康科学与技术、电气工程与计算机科学的John and Dorothy Wilson教授,也是麻省理工学院科赫癌症综合研究所和医学工程与科学研究所的成员。
这项新研究发表在本周的美国国家科学院院刊他发现了一种似乎起关键作用的分子,还发现了其他几个候选分子,研究人员计划进一步探索。
该论文的第一作者是前麻省理工学院研究生和博士后Arnav Chhabra。
芯片上的再生
大多数需要的病人肝移植患有慢性疾病,如病毒性肝炎、脂肪肝或癌症。然而,如果研究人员有一种可靠的方法来刺激肝脏自行再生,一些移植就可以避免,Bhatia说。或者,这种刺激可能被用来帮助移植后捐献的肝脏生长。
通过对小鼠的研究,研究人员了解到肝脏损伤或疾病后激活的一些再生途径。一个关键因素是肝细胞(肝脏中发现的主要细胞类型)和内皮细胞之间的相互关系血管.肝细胞产生帮助血管发育的因子,内皮细胞产生帮助肝细胞增殖的生长因子。
研究人员发现的另一个因素是流体流动在血管里。在小鼠体内,血流增加可以刺激内皮细胞产生促进再生的信号。
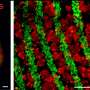
为了模拟所有这些相互作用,Bhatia的实验室与Christopher Chen合作,Christopher Chen是波士顿大学William F. Warren生物医学工程杰出教授,他设计了带有模拟血管通道的微流体设备。为了创建这些“芯片再生”模型,研究人员沿着这些微流体通道培育血管,然后添加来自人类器官捐赠者的肝细胞的多细胞球形聚集物。
芯片是这样设计的分子如生长因子可以在血管和肝球之间流动。这种设置还允许研究人员轻松地敲除特定细胞类型中感兴趣的基因,然后观察它如何影响整个系统。
使用这个系统,研究人员表明增加的液体流量本身不会刺激肝细胞进入细胞分裂周期。然而,如果它们也传递炎症信号(细胞因子il -1- β),肝细胞确实进入了细胞周期。
当这种情况发生时,研究人员能够测量产生了什么其他因素。其中一些是根据早期的小鼠研究预期的,但其他的在人类细胞中从未见过,包括一种名为前列腺素E2 (PGE2)的分子。
麻省理工学院的研究小组在斑马鱼的肝脏再生系统中发现了高水平的这种分子,它也参与了斑马鱼的再生。通过敲除PGE2基因的生物合成内皮细胞,研究人员能够证明这些细胞是PGE2的来源,他们还证明了这种分子具有刺激作用人肝细胞进入细胞周期。
人类特有的路径
研究人员现在计划进一步探索其他的一些生长因子以及在肝脏再生过程中芯片上产生的分子。
“我们可以观察产生的蛋白质,然后问,这个列表上还有什么与其他刺激细胞分裂的分子具有相同的模式,但却是新奇的?”巴蒂亚说。“我们认为,我们可以利用这一点来发现新的人类特异途径。”
在这项研究中,研究人员专注于刺激分子细胞进入细胞分裂,但他们现在希望进一步跟踪这一过程,识别完成细胞周期所需的分子。他们还希望发现告诉肝脏何时停止再生的信号。
Bhatia希望最终研究人员能够利用这些分子来帮助治疗肝功能衰竭患者。另一种可能性是,医生可以利用生物标记等因素来确定患者肝脏自行再生的可能性有多大。
“现在,当病人出现肝功能衰竭时,你必须对他们进行移植,因为你不知道他们是否能自己恢复。但如果我们知道谁有强劲的再生反应,如果我们只需要稳定他们一段时间,我们就可以让这些患者免于移植,”Bhatia说。
进一步探索