有毒蛋白质“变体”可能是ALS疗法的下一个目标
科学家们早就知道,蛋白质可以在阿尔茨海默病、帕金森病和肌萎缩性侧索硬化症(ALS)等神经退行性疾病中形成有害的簇。但宾夕法尼亚州立大学的研究人员的一项新研究表明,一种与ALS病理相关的蛋白质的“变体”复合物以不同的途径形成,这一发现可能会使药物开发人员更容易设计针对更有害变体的治疗方法。
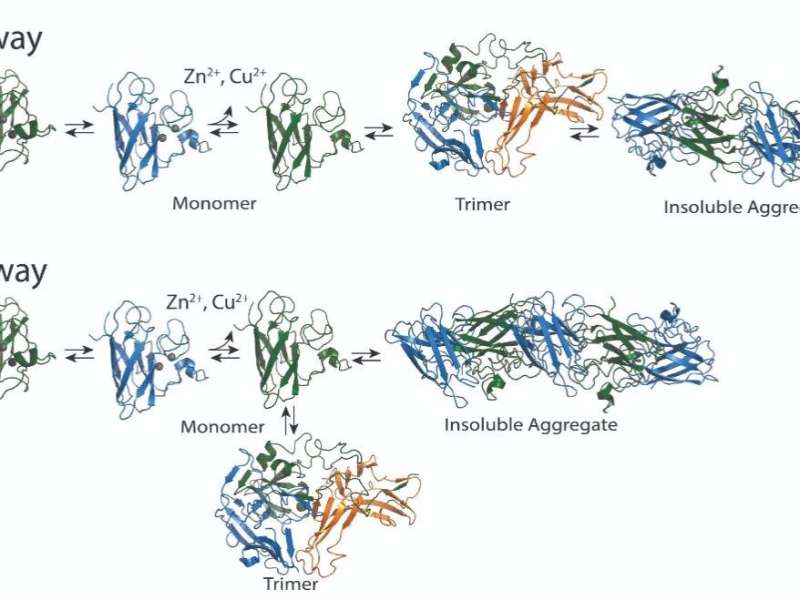
超氧化物歧化酶(SOD1)是一种聚集蛋白,有助于肌萎缩性侧索硬化症的发生和发展,但尚不清楚它是通过何种生物学机制来实现这一点的。该蛋白的突变与15-30%的家族性ALS病例和1-2%的自发性ALS病例有关。通常存在于两部分二聚体中,SOD1铜或锌离子的损失会导致它分离成两个独立的单体或单元。单体可以形成三聚体,或三组分形式,或聚合成更大的原纤维,由许多SOD1单体组成。先前的研究表明,三聚体形式对细胞有毒。其他研究表明,更大的聚合形式实际上可能具有保护功能。
确定三聚体是否需要形成更大的聚集物,或者它是否与聚集物的形成竞争,可以帮助确定治疗策略。宾夕法尼亚州立大学医学院G. Thomas Passananti教授、药理学研究副主席Nikolay Dokholyan和宾夕法尼亚州立大学工程学院生物医学工程系研究生Brianna Hnath通过他们的工作发现,三聚体与较大的聚合体以独立的、竞争性的路径发展。
Hnath说:“确定三聚体的形成是独立于大规模聚集发育还是其中的一部分,可能会影响我们在药物上治疗ALS等疾病的方式。”“目前的治疗方法专注于分解大的聚集物,但在聚集物具有保护作用的情况下,专注于针对三聚体的形成可能会更好。”
Hnath和Dokholyan设计了稳定的SOD1三聚体突变体,并使用神经元样细胞模型,发现稳定的SOD1三聚体增加了细胞死亡。他们还确定,稳定三聚体可以防止细胞模型中纤维的形成。这一观察结果促使他们进行了色谱实验,他们发现SOD1三聚体直接与SOD1单体的纤维大复合体竞争。
最重要的是,研究人员确定三聚体结构的形成独立于较大的聚集体,这证实了三聚体的形成不是SOD1纤维聚集体构建途径的一部分。研究结果发表在生物物理期刊.
“这一发现意义重大,因为它向我们表明,肌萎缩性侧索硬化症的治疗策略可以集中在抑制有毒三聚体的形成,而不是像治疗阿尔茨海默氏症的一些药物那样,只针对纤维聚集物,”Dokholyan说,他也是生物化学和医学教授分子生物学,生物医学工程他是宾夕法尼亚州立大学癌症研究所和宾夕法尼亚州立大学神经科学研究所的研究人员。“较小的寡聚物对渐冻症有毒这一事实是一个相对较新的理论,仍需要进一步的探索和验证。”
Dokholyan和Hnath计划进行研究,以更好地了解SOD1三聚体的结构及其方式蛋白质相互作用与肌萎缩性侧索硬化症的发展和进展有关。