CRISPR技术强调了导致肺气肿和慢性阻塞性肺病的基因
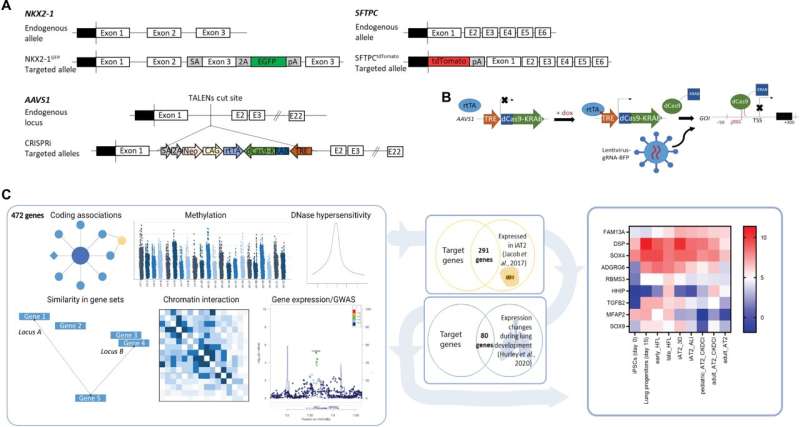
来自波士顿医学中心和波士顿大学医学院再生医学中心的研究人员使用CRISPR的变体来了解导致肺气肿和慢性阻塞性肺疾病(COPD)的基因的功能。发表在科学的进步在美国,研究人员通过关闭与这些疾病发病有关的基因的表达,发现了功能上的后果。
“这是CRISPRi和CRISPRa首次应用于人类诱导多能干细胞来了解这些基因的功能作用,”波士顿医疗中心的肺科医生、波士顿大学医学院的医学副教授安德鲁·威尔逊医学博士说。“这让我们更接近于理解遗传因素是如何有助于导致肺气肿易感性的。”
慢性阻塞性肺病和肺气肿是全球第三大死亡原因,造成了严重的疾病负担。肺气肿是一种复杂的遗传疾病,由一些基因的突变或变异引起,导致一些人比其他人更容易患病。全基因组关联研究(GWAS)已经涉及到越来越多的基因中或附近的变异,但了解它们的功能以及它们如何潜在地促进慢性阻塞性肺病和肺气肿的发展是相当有限的。
波士顿医学中心和波士顿大学医学院再生医学中心博士后Rhiannon Werder医学博士说:“目前还没有开发出新的重要的药物来帮助治疗全球范围内的大量慢性阻塞性肺病或肺气肿患者。”“我们希望这项研究将有助于理解这种疾病的遗传学,提高我们对这种疾病是如何发生的理解细胞水平上并支持开发治疗这些疾病的新疗法。”
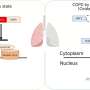
研究人员设计了一个系统,使用CRISPR的变体,要么使用CRISPR干扰(CRISPRi)关闭感兴趣的基因的表达,要么使用CRISPR激活(CRISPRa)过表达感兴趣的基因诱导多能干细胞(万能)。研究人员在培养皿中培养这些细胞,并将它们分化,生成驻留在肺部的细胞。研究的细胞类型被称为2型肺泡上皮细胞,肺泡的祖细胞——肺泡是肺中发生气体交换的部分,也是肺气肿中受损的结构。因此,通过了解GWAS基因如何影响2型细胞,研究人员可以开始了解这些基因是如何导致影响这些细胞的疾病的,比如肺气肿。
一旦2型细胞生成,研究人员使用CRISPRi关闭9种不同的GWAS基因的表达,并分析它们,看看细胞是如何受到影响的,特别是它们的增殖能力,这是它们需要能够应对的损伤,如发生在肺气肿.研究人员注意到,关闭一种特殊的基因,纤维板蛋白(DSP),会导致细胞增殖增加,并增加细胞成熟相关基因的表达。研究人员发现,在烟雾暴露前关闭DSP表达的细胞,其细胞连接基因表达的关闭程度比对照组更大。它们也比对照组更善于形成新的菌落,这是衡量祖细胞功能的一项指标。然后,研究人员观察了从肺中删除了DSP的老鼠上皮细胞与正常DSP的对照组小鼠相比。研究人员发现,DSP缺失小鼠的2型细胞在损伤后增殖能力更强,这与人类ipsc衍生的2型细胞的发现一致。
DSP似乎可以调节2型细胞在基线和损伤后的增殖能力人类疾病,如接触烟雾。较低水平的DSP表达增加了系统中2型细胞的增殖能力,可能使它们能够更好地对损伤做出反应。相比之下,GWAS在含有与COPD风险相关的变异的细胞中发现的更高水平的表达似乎使细胞在烟雾暴露后增殖减弱,这可能解释了该基因是如何导致疾病的。