研究人员在神经元中发现了新的光门控钾通道

理解大脑的一个关键方法是观察打开特定神经元群体的行为影响。控制模型系统中神经元活动的最流行的方法之一被称为光遗传学,它依赖于在感兴趣的神经元中表达微生物光门控通道。
这些通道就像光响应开关一样,在闪光的情况下启动神经元,这种通道自2005年就开始使用了。确认神经元群体功能的一个关键方法是重复这个实验,但这一次是关闭或沉默相同的神经元亚群体。然而,直到现在,神经科学学界还缺乏一种快速有效的方法来关闭或使神经元沉默。
德克萨斯大学休斯顿麦戈文医学院健康科学中心、贝勒医学院、莱斯大学和加拿大安大略Guelph大学的研究人员报告了一种新的光门控通道,有望为快速有效的光学神经元沉默铺平道路。
发表在自然神经科学在美国,研究人员描述了他们如何识别第一个自然光门控钾(钾)通道-视紫红质(KCRs)。
“长期以来,人们一直在寻找光激活的钾通道作为神经元消音器,因为钾电导自然和普遍地使神经元膜超极化,终止动作电位并使去极化的神经元恢复到它们的静息膜电位,”该研究的主要作者、麦戈文医学院罗伯特·A·韦尔奇化学杰出主席约翰·斯普迪奇博士说。
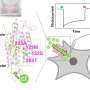
通过系统筛选无特征视蛋白(与光反应性化学物质结合的蛋白质)的电生理特性,研究人员利用膜片钳光电流筛选HEK293细胞中表达的无已知功能的视蛋白编码基因,寻找具有难以捉摸的钾选择性的通道视紫红质。
Spudich说:“我们的筛选策略包括强调来自生物的视蛋白,这些生物的代谢和栖息地与之前研究的含视蛋白生物不同,因此,在进化过程中更有可能进化出不同的视蛋白功能,以适应不同的选择压力。”“这一策略使我们从链藻Hyphochytrium catenoides的测序基因组中找到了两个视蛋白编码基因,这是一种非光合作用、异养真菌样原生生物,在系统发育和生理上都与含有密切相关的钠选择性CCRs的藻类很远。”
Spudich实验室的副教授、第一作者Elena Govorunova博士说:“我们发现,悬链藻中的两种视紫红质通道——我们将其命名为HcKCR1和HcKCR2,分别代表悬链藻钾通道-视紫红质1和2——与其他已知的视紫红质通道不同,它们对钾的选择性高于钠。”“特别是,23的渗透比(PK/PNa)使HcKCR1成为抑制可兴奋神经元在光照下放电的强大超极化工具。”
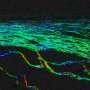
薛明山博士在贝勒的实验室和凯恩基金会实验室,德克萨斯州儿童医院的简和丹邓肯神经学研究所,然后在神经元中测试了这些新工具。
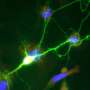
“当我的学生Gou岳阳在小鼠神经元中表达HcKCR1并施加闪光灯时,神经元变得电沉默。该通道克服了以前抑制剂的许多限制,将成为帮助我们了解大脑功能的关键工具,”贝勒大学的教员和这项工作的合著者薛说。
随后,贝勒和莱斯大学圣皮埃尔实验室的研究生Xiaoyu Lu演示了使用双光子激发也可以实现沉默,双光子激发是一种流行的技术,用于靶向体内个体神经元,具有高时空分辨率。“KCRs的双光子控制可能使神经科学家能够破译哪些神经元对特定行为至关重要,以及何时它们的活动是重要的,”François St-Pierre博士说,他是贝勒大学的神经科学助理教授和McNair学者,也是这项工作的合著者。
“这项工作是休斯敦多机构合作产生创新研究的一个极好的例子。休斯敦正在成为开发和应用尖端分子神经技术的首选地。”
下一步,研究小组将评估KCRs在体内使神经元沉默的能力,并继续研究它们的生物物理机制,以设计更好的变体。从长远来看,他们还希望kcr能用于治疗钾通道疾病,如癫痫、帕金森病、长qt综合征和其他心律失常。