新的蛋白质复合物结构揭示了靶向关键癌症途径的可能方法
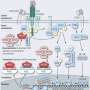
一些最臭名昭著的癌症驱动因素是RAS基因突变,它导致大约四分之一的癌症患者的肿瘤生长。麻省理工学院和哈佛大学的布罗德研究所以及达纳-法伯癌症研究所的科学家们已经确定了一种名为SHOC2的ras途径蛋白质的分子结构,以及与之结合的另外两种蛋白质。这三种蛋白质组合被称为SHOC2-MRAS-PP1C(“SMP”)复合体,调节RAS信号通路,帮助RAS突变的癌细胞存活。
通过x射线晶体学和低温电子显微镜揭示了该复合物的高分辨率结构,提示了药物可以结合到其上抑制RAS通路并阻断的可能方法癌症增长。这项研究发表在自然这篇论文强调了一种针对一种信号通路的潜在治疗策略,而这种信号通路一直难以被药物靶向。这项工作是Dana-Farber、Deerfield发现与开发公司(Deerfield管理公司的子公司)、Broad癌症项目、遗传扰动平台和治疗学发展中心(CDoT)的研究人员合作的结果。
“通过解决这个结构,我们已经了解了很多关于SHOC2在这个电路中是如何运作的,这指出了可以进行治疗干预的方法,”该研究的资深合著者、布罗德研究所癌症项目成员威廉·哈恩说。Hahn也是William Rosenberg医学教授,Dana-Farber的执行副总裁和首席运营官。
SHOC2故事
Hahn、共同资深作者Andrew Aguirre (Dana-Farber的肿瘤学家和Broad的副成员)以及Jason Kwon (Hahn实验室的博士后)于2019年首次将SHOC2确定为可能的药物靶点。他们和布罗德癌症依赖图项目的同事们正在研究癌症的基本基因突变在RAS蛋白中。当时,一种叫做MEK抑制剂的癌症药物已经被开发出来,用于靶向RAS蛋白的突变,但它们只对一小部分癌症患者有效。研究小组想知道是否有另一种蛋白质使突变的RAS蛋白质绕过这些抑制剂。
在2019年的研究中,该团队使用CRISPR-Cas9在整个基因组中逐个敲除基因,以观察哪些基因可能导致ras突变的癌细胞抵抗MEK抑制剂的影响。研究人员发现,当他们删除SHOC2基因或减少其表达时,MEK抑制剂在消除方面非常有效癌症细胞,揭示了SHOC2是MEK抑制剂耐药的罪魁祸首。
蛋白质的难题
该团队决定进一步研究将SHOC2作为一个潜在目标,其中包括解决它的结构。这时,CDoT和迪尔菲尔德发现与开发公司的研究人员加入了这个团队。
“我们从基因上识别了SHOC2,并知道它很重要,但为了在治疗上利用它,我们必须了解蛋白质的结构,以确定关键的功能区域,”该论文的项目负责人和共同第一作者Kwon说。
该团队与CDoT的科学家合作,包括研究科学家Behnoush Hajian、计算科学家Yuemin Bian和蛋白质科学与结构生物学主任Christopher Lemke等共同第一作者。他们使用x射线晶体学和低温电子显微镜来解决SHOC2的高分辨率结构以及与之相互作用的蛋白质。
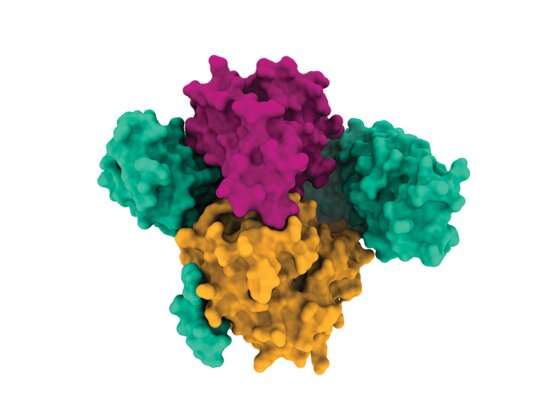
他们发现,就其本身而言,SHOC2是一种表面光滑的马蹄形脚手架蛋白,这使得药物很难与之结合。然而,进一步的分析揭示了SHOC2如何结合到两个关键蛋白PP1C和MRAS上的结构细节,这两个蛋白也是RAS信号通路的一部分。该团队解决了这个三蛋白质SMP复合体的结构,揭示了组成蛋白质之间的新口袋,研究人员可以在那里放入一种药物。
布罗德研究所的科学家、CDoT的高级主任亚历克斯·伯金说:“你看着SHOC2,你会想‘我用它做不了什么’。”“但当我第一次看到SMP复合物时,我马上就看到了多个可以结合药物的口袋。我一看到这个结构就非常兴奋,因为它开辟了一条新的前进道路。”
从结构到功能
科学家们与Broad基因扰动平台的同事们一起,使用一种叫做深度突变扫描的方法,分析了SHOC2每个氨基酸的突变对蛋白质功能的影响。他们生成的数据可以用来确定SHOC2突变和其他疾病之间的新联系。例如,之前的研究表明,这种突变蛋白质会导致努南样综合征,这是一种影响身体特征发育的先天性疾病。
哈恩说:“真正有利的是,通过已经测试了每一个可能的突变,你可以迅速了解和合理的结构,并确信这些突变的后果是什么。”“我认为这篇论文真正揭示了这些信息是多么强大。”
研究人员希望他们的发现将澄清SHOC2突变的临床相关性,并帮助制药商找到与SMP复合物结合以关闭SHOC2的化合物。该研究的目的是开发针对SMP复合物的新药,这些药物可以单独或与MEK抑制剂联合作用,抑制RAS突变的影响,并有效阻止癌症生长。
“通过出色的团队合作,利用在癌细胞信号、功能基因筛选和结构生物学,我们已经能够迅速地从发现作为高优先靶点的SHOC2到药物开发的全面结构-功能路线图。我们希望这项工作开辟了有希望的途径,为ras突变癌症创造急需的新疗法,”Aguirre说。
Rita Sulahian等,ras驱动癌症中SHOC2缺失与MEK抑制的合成致死相互作用,细胞的报道(2019)。DOI: 10.1016 / j.celrep.2019.08.090