科学家们把注意力集中在帕金森氏症的遗传原因上

至少有20种不同基因的变异与帕金森氏症的发展密切相关,但科学家们仍在研究它们究竟是如何导致这种严重且无法治愈的运动障碍的。这种疾病仅在美国就折磨着约100万人。
耶鲁大学研究人员的新研究提供了重要线索。在两篇新发表的论文中,科学家们对一种名为VPS13C的蛋白质的功能进行了深入研究。VPS13C是帕金森氏症的分子嫌疑犯之一。帕金森氏症的特征是不可控的运动,包括颤抖、僵硬和失去平衡。
“通往罗马的路有很多;同样,通向帕金森症的道路也有很多,”耶鲁大学约翰·克林根斯坦神经科学教授、细胞生物学教授、霍华德·休斯医学研究所研究员Pietro De Camilli说。“耶鲁大学的实验室正在朝着阐明这些路径的方向取得进展。”
De Camilli是这两篇新论文的资深作者细胞生物学杂志而且美国国家科学院院刊(PNAS).
先前的研究表明,VPS13C基因突变会导致罕见的遗传性帕金森症或增加患病风险。为了更好地理解其中原因,细胞生物学和分子生物物理与生物化学的大卫·w·华莱士教授De Camilli和Karin Reinisch研究了这些突变在细胞水平上导致功能障碍的机制。
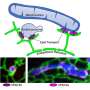
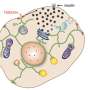
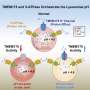
2018年,他们报告说VPS13C在两个亚细胞细胞器之间形成了桥梁内质网和溶酶体。内质网是调节大多数磷脂的合成的细胞器,磷脂是构建细胞膜所必需的脂肪分子。溶酶体充当细胞的消化系统。他们还表明VPS13C可以运输脂质,这表明它可能在这两个细胞器之间形成了脂质运输的通道。
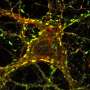
De Camilli实验室的一篇新论文表明,缺乏VPS13C会影响溶酶体的脂质组成和性质。此外,他们发现,在人类细胞系中,这些干扰激活了先天免疫。这种激活,如果发生在大脑组织会引发神经炎症,最近的几项研究表明,这一过程与帕金森症有关。
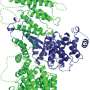
De Camilli实验室的第二篇论文使用了最先进的低温电子断层扫描技术,揭示了这种蛋白质在其原生环境中的结构,支持脂质运输的桥梁模型。刘军,耶鲁大学微生物病机学教授,本研究的共同通讯作者。
理解这些细粒度分子细节研究人员说,这将对了解导致帕金森病的至少一条途径至关重要,并可能有助于确定预防或减缓疾病的治疗靶点。
耶鲁大学的William Hancock-Cerutti是发表在《细胞生物学杂志蔡树军是发表在PNAS.
进一步探索
蔡树军等,脂质转运蛋白VPS13C在er溶酶体膜接触处的原位结构,美国国家科学院院刊(2022)。DOI: 10.1073 / pnas.2203769119