2022年8月17日功能
鼻内疫苗接种可在动物模型中产生对艾滋病毒和SARS-CoV-2的有效全身免疫
尽管大多数病毒直接通过粘膜细胞引起感染,但绝大多数疫苗在细胞不匹配的情况下肌肉注射,并不总是产生最佳的免疫效果。
SARS-CoV-2通过鼻粘膜感染,HIV通过生殖器和肛门黏膜感染。但这两种病毒并不是唯一的,许多其他病毒,包括那些导致流感、麻疹和脊髓灰质炎的病毒——以及许许多多其他病毒——都是通过粘膜组织感染人类的。
现在,一个由多个机构组成的大型科学家团队正在研究一种鼻内免疫方法,以确定是否有可能通过直接接种粘膜细胞来产生对艾滋病毒和SARS-CoV-2的有效保护。科学家们通过开发一种方法,将疫苗蛋白质穿过有时不屈服的粘膜边界,从而取得了这些成就。迄今为止,该研究已在动物模型-小鼠和非人灵长类动物但目前的研究结果表明,这是一种有望在人体临床试验中进行测试的方法。
麻省理工学院的布列塔尼·哈特韦尔(Brittany Hartwell)及其来自多个美国合作机构的同事写道:“为了抗击艾滋病毒流行和新出现的威胁,如SARS-CoV-2,需要免疫策略在病原体进入的粘膜入口引起保护。”他们的调查发表在科学转化医学.
“直接通过气道表面免疫在促进黏膜免疫方面是有效的,但通过粘液和上皮粘膜吸收疫苗不足是一个限制。主要的血液蛋白白蛋白在气道上皮上双向跨细胞。”
白蛋白通常对进入粘膜细胞的疫苗有效载荷不友好。由于这一障碍,通过粘膜途径接受疫苗受到了限制。通过开发一种全新的策略,使有效载荷有效地进入粘膜细胞,这组科学合作者即将迎来一项新的科学创新,确保免疫蛋白的输送。
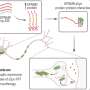
在他们的期刊报告中,哈特韦尔和他的同事提出了一种他们称之为“双肽蛋白”的策略,这种策略允许免疫刺激蛋白“搭便车”穿过粘膜表面。它们的角蛋白由病毒蛋白结合到两亲性尾巴上,结合白蛋白(一种血液蛋白),从而通过与新生儿Fc受体相互作用通过黏膜。新生儿Fc受体,或称FcRn,也被称为Brambell受体。它保护抗体、IgG或免疫球蛋白- g和白蛋白免受分解代谢,也引导IgG穿过上皮细胞。
该团队转向动物模型,以确定这种实验性的鼻内方法是否可以有效地通过黏膜表面传递免疫蛋白,并产生针对两种臭名昭著的病毒:艾滋病毒和SARS-CoV-2的有效疫苗免疫。研究表明鼻内接种疫苗可产生系统免疫。
在实验中,科学家们知道鼻内疫苗比肌肉注射疫苗能引起更强、更有保护作用的抗体反应。但他们也清楚地意识到,一些实验性粘膜疫苗由于在粘膜衬里的疫苗吸收不良而受到限制。
他们想知道的是,是否有可能调整疫苗的输送方式,进而证明粘膜接种途径如何导致更强大的抗体反应。如果他们能做到这一点——他们的研究最终证明了他们可以做到——那么他们就即将研制出一种疫苗,可以对艾滋病毒和sars - cov -2以及任何潜在的变种提供保护。他们的第一步是开发一个可以在老鼠和非人类灵长类动物身上测试的疫苗平台。
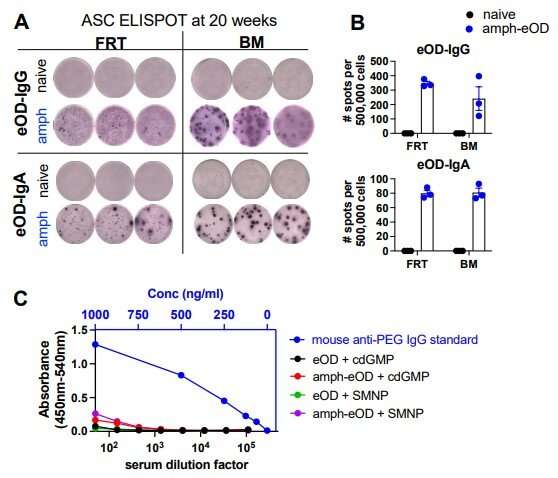
当与HIV蛋白Env gp120或SARS-CoV-2的受体结合域配制时,这种两性两性蛋白在免疫小鼠和非人灵长类动物的血清和鼻黏膜中引发了强烈的抗病毒抗体反应。
哈特韦尔写道:“与未修饰的蛋白质相比,用两性结合的HIV Env gp120或SARS-CoV-2受体结合结构域蛋白鼻内免疫小鼠的血清、上下呼吸道黏膜和远端生殖泌尿黏膜中抗原特异性IgG和IgA滴度高100至1000倍。”他指的是免疫球蛋白g和免疫球蛋白a抗体。
“Amph受体结合区域免疫在血清、鼻腔洗液和支气管肺泡灌洗液中诱导高滴度的sars - cov -2中和抗体。此外,与未修饰的蛋白质相比,恒河猴鼻内双环蛋白免疫在血清和鼻黏膜中诱导了10倍以上的抗原特异性IgG和IgA反应,支持了这种方法的翻译潜力,”Hartwell在论文中说。
结果表明,使用amph-蛋白质通过粘膜上皮细胞传递抗原的疫苗是一种很有前途的策略,可以促进黏膜对艾滋病毒、SARS-CoV-2和最终其他病毒的免疫传染病随着使用这一策略的其他疫苗的开发。“amph蛋白在鼻粘膜在小鼠和非人灵长类动物中表现出更多的吸收到组织中,导致鼻相关淋巴组织的生发中心反应增强,”哈特韦尔总结道。
加州大学旧金山分校生物工程和治疗科学系教授弗朗西斯·斯卡(Francis Szoka)赞扬了哈特韦尔及其同事的疫苗研究的创新方法。“这些结果可能预示着一种预防艾滋病毒感染的疫苗的可能性,并有可能有助于实现对变种不可知的SARS-CoV-2的目标疫苗, Szoka在一篇相关的聚焦文章(发表于科学转化医学),探讨了该研究的临床意义。
Francis C. Szoka,《粘膜和系统免疫的搭便车指南》,科学转化医学(2022)。DOI: 10.1126 / scitranslmed.adc8697
©2022科学欧宝app网彩X网