辉瑞要求FDA批准ommicon特异性增强疫苗
辉瑞公司(Pfizer Inc.)周一表示,已要求美国食品和药物管理局(fda)批准紧急使用一种针对多种omicron变体的升级强化疫苗。
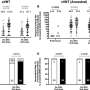
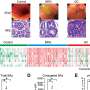
动物研究表明,新的mRNA疫苗产生一种免疫反应针对BA.4和BA.5子变种,与临床试验该公司在一份声明中说,计划于本月开始新闻发布会上发布应用程序。
“mRNA平台的灵活性,加上辉瑞-生物科技COVID-19疫苗的广泛临床经验,使我们能够开发、测试和生产更新的高质量疫苗,以适应流通菌株辉瑞董事长兼首席执行官阿尔伯特·波拉在新闻发布会上说。“在迅速扩大生产后,我们将立即开始销售双价欧米克隆BA.4/BA。5个助推器,如果得到授权,帮助保护个人和家庭,为可能的秋冬潮做准备。”
BA.5亚型占美国COVID-19新病例的近90%,根据美国疾病控制和预防中心。
FDA计划在9月份对数据进行审查。如果得到批准疫苗可以立即分发NBC新闻报道。哈佛大学流行病学家比尔·哈纳奇博士告诉新闻媒体,这种新疫苗的周转时间“非常快”。疫苗的研发和分发通常需要数年时间,而最新的欧米克隆亚变异直到6月初才开始在美国广泛传播。
版权©2022每日健康.保留所有权利。