针对ARID1A缺陷的膀胱癌的潜在治疗
转移性膀胱癌通常是无法治愈的,因此新疗法是迫切需要的。阿拉巴马大学伯明翰大学的研究人员现在报告了对四分之一的膀胱癌的潜在治疗方法。
他们的发现,发表在期刊上JCI洞察力,来自基因变化的机械见解和改变了抗抗药性的靶标和机制的信号传导途径。
UAB研究的重点是基因ARID1A中的突变,这是染色质修饰复合物的关键部分细胞核。染色质是DNA和蛋白质的混合物,它们在每个细胞内紧密包装5英尺长的染色体DNA,并且染色质修饰剂作用以帮助打开或关闭基因表达。在大约20%的膀胱肿瘤中可以看到ARID1A灭活突变
这项研究的基础是癌症先前的各种研究。首先,称为EZH2的组蛋白甲基转移酶被认为是导致的癌基因正常细胞成为癌细胞,因为它在许多侵略性癌症中过表达,并且被认为可以驱动细胞的生长,如主要作者和其他作者所示。EZH2可以沉默基因,包括抑制肿瘤生长的作用的基因,称为肿瘤抑制因子。其次,先前的研究表明,ARID1A中的突变用EZH2特异性的小分子GSK-126对细胞对药理抑制作用敏感。
因此,由James“ Jed” Ferguson III,医学博士,博士学位和Sooryanarayana Varambally博士领导的研究人员假设,具有ARID1A突变的膀胱癌细胞对EZH2抑制作用,可以用作EZH2的敏感性,可以用作EZH2抑制患有ARID1A缺陷膀胱癌患者的治疗靶标。弗格森(Ferguson)是UAB泌尿外科系的助理教授,Varambally是UAB病理学系分子和细胞病理学系的教授。
研究人员对现有数据集的分析表明,多达29%的膀胱癌在ARID1A中有胡说八道或截断突变,并且这些肿瘤的EZH2也很高。此外,研究人员称之为ARID1AMUT的几种现有膀胱癌细胞系具有突变,而其他膀胱癌细胞系没有ARID1A突变。
使用这些细胞系,研究人员表明,通过活力和增殖,gsk-126在细胞培养中对gsk-126抑制EZH2抑制EZH2抑制EZH2抑制EZH2敏感。在小鼠异种移植物中,使用膀胱癌细胞系和患者来源的膀胱癌细胞,GSK-126停止了含有ARID1AMUT的癌细胞的生长,而不是具有野生型ARID1A的癌细胞。
Ferguson和Varambally接下来假设缺乏ARID1A缺陷的细胞对GSK-126敏感,这是由于对特定肿瘤抑制剂的转录上调,这些抑制剂在ARID1A野生型细胞中保持转录抑制。他们将经GSK-126处理的ARID1A野生型膀胱癌细胞系与GSK-126处理的ARID1A敲低进行了比较细胞系。ARID1A敲低细胞的ARID1A较少,并且对GSK-126抑制的敏感性类似于Arid1amut细胞。
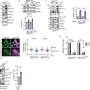
在大约70个差异表达的基因中,一个是值得注意的 - 通过减弱细胞信号途径PI3K/AKT/MTOR来起作用的肿瘤抑制PIKIP1。该途径对于调节健康细胞的细胞增殖和生长很重要。但是在许多癌症中,它是过度活跃的,会导致不受约束的细胞增殖。
具有野生型ARID1A的健康细胞使用MAPK信号通路,但是研究人员发现,具有Arid1amut或arid1a敲低的细胞使用不同的途径。这些癌细胞取决于PI3K信号传导,以激活PI3K/AKT/MTOR途径以生存,这是由于PI3K的相对未表征的调节亚基的上调所致,称为PIK3R3。
研究人员在人膀胱癌的临床裂解液中证实了这一点,表明缺乏ARID1A蛋白的肿瘤具有升高的PIK3R3和磷酸盐水平,其中磷酸盐是PI3K/AKT/MTOR途径中Akt的活性形式。
潜在的临床重要性,研究人员表明,ARID1A缺陷膀胱癌对与EZH2抑制剂GSK-126的联合疗法和几种PI3K抑制剂敏感,并以协同的方式起作用。
弗格森说:“因此,我们的研究表明,具有ARID1A突变的膀胱癌可以用EZH2和/或PI3K的抑制剂治疗。”弗格森(Ferguson)和Varambely指出,ARID1A经常在各种各样的人类癌症中突变,包括膀胱,胃,胰腺和卵巢癌。借助FDA批准的EZH2抑制剂,首席作者讨论了在杂志上出现的先前评论中针对癌症中EZH2的可能性癌症研究。
研究人员的进一步机械研究表明,ARID1A缺陷膀胱癌中的EZH2抑制剂敏感性细胞是由于PIK3IP1的上调,PIK3IP1是PI3K信号传导的蛋白质抑制剂。研究人员还首次表明,PIK3IP1通过诱导PIK3R3的蛋白酶体降解来抑制PI3K信号传导。为了支持这些发现,他们表明PIK3R3上调是必需的,足以满足PI3K/AKT途径的激活和增加的膀胱癌症细胞增殖。同样,他们表明PIK3IP1上调是必需的,足以足以用于GSK-126介导的ARID1A缺陷中的细胞死亡膀胱癌细胞。
Marie-Lisa Eich等人,EZH2靶向癌症的疗法:炒作或现实,癌症研究(2020)。doi:10.1158/0008-5472.CAN-20-2147