研究人员为罕见ciliopathy开发基因疗法
美国国家眼科研究所的研究人员(NEI)已经开发出一种基因疗法,拯救视网膜细胞纤毛缺陷影响的型利伯氏先天性黑内障(LCA),导致失明的疾病在早期的童年。使用patient-derived视网膜瀑样(也称为retinas-in-a-dish),研究人员发现,一种LCA由突变引起的NPHP5(也称为IQCB1)基因导致的严重缺陷初级纤毛结构中发现几乎所有身体的细胞。研究结果不仅揭示NPHP5蛋白质在初级纤毛的功能,而且还导致了一个潜在的治疗这炫目的条件。NEI是美国国立卫生研究院的一部分。
“这是如此悲伤看到小孩子从早发性LCA失明。NPHP5不足导致其早期失明温和的形式,在更严重的形式,很多患者也表现出肾脏疾病视网膜变性说:“该研究的首席研究员,阿南德•Swaroop博士的资深研究员NEI神经生物学神经退化和修复实验室。“我们设计了一个基因治疗方法,可以帮助防止儿童失明的这种疾病和一个额外的研究,甚至可以帮助治疗疾病的其他影响。”
LCA是一种罕见的遗传性疾病导致的感光视网膜变性的眼睛。至少25个不同的基因缺陷可能导致LCA。虽然有一个可用的基因疗法治疗LCA的一种形式,其他形式的疾病没有治疗。LCA的类型由突变引起的NPHP5相对比较少见。它会导致失明在所有情况下,在许多情况下,它也可以导致肾脏的失败,一个条件Senior-Løken综合症。
三个博士后,卡米尔Kruczek博士Zepeng瞿,博士和艾米丽Welby,博士,研究团队的其他成员一起收集干细胞样本两个患者NPHP5在美国国立卫生研究院临床中心不足。这些干细胞样本用于生成视网膜瀑样,培养组织集群拥有许多实际的结构和功能特性,本机视网膜。Patient-derived视网膜瀑样特别有价值,因为他们密切模仿实际患者的基因型和视网膜疾病表现和提供“人形”组织环境测试治疗干预措施,包括基因疗法。的病人,这些视网膜光感受器瀑样显示缺陷,包括损失的部分光感受器被称为“外段。”
在一个健康的视网膜光感受器外段包含感光分子称为视蛋白。暴露于光线外节时,感光启动的信号传递给大脑神经信号,调节视力。光感受器外节是一种特殊类型的初级纤毛一个古老结构发现,几乎在所有动物细胞。
在一个健康的眼睛,NPHP5蛋白质被认为坐在gate-like结构底部的初选纤毛这有助于筛选蛋白质进入纤毛。以前在白鼠身上进行的相关研究曾显示,NPHP5参与纤毛,但是研究人员还不知道的确切作用NPHP5感光纤毛,也不清楚如何突变影响蛋白质的功能。
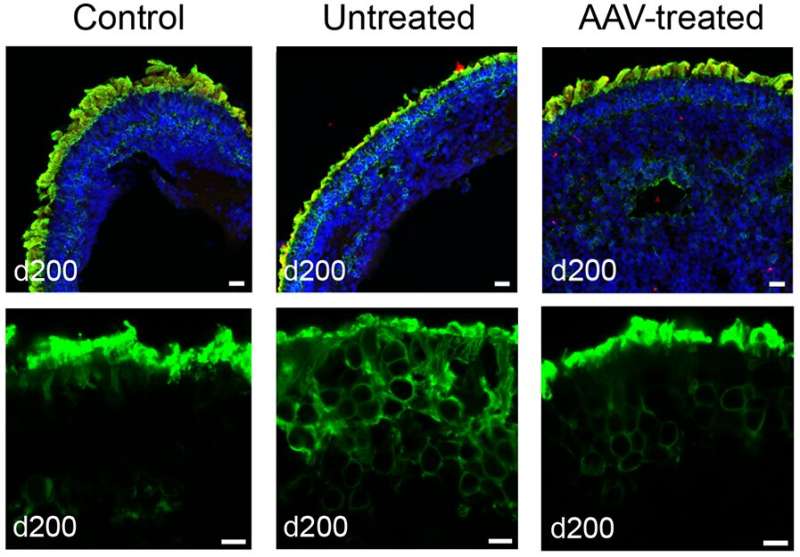
在目前的研究中,研究人员发现减少水平的NPHP5 patient-derived视网膜瀑样细胞内的蛋白质,以及减少另一个叫做cep的蛋白质- 290的水平,这与NPHP5交互,形成初级纤毛门。(突变cep - 290构成了LCA的最常见原因。)此外,在视网膜光感受器外段瀑样完全失踪,应该被本地化的视蛋白的蛋白质外段而不是被发现在光感受器细胞的身体。
当研究人员引入了腺相关病毒(AAV)载体包含一个功能的版本NPHP5作为基因治疗载体,视网膜瀑样显示显著恢复视蛋白的蛋白质外段集中在适当的位置。研究结果还表明,功能NPHP5可能稳定初级纤毛门口。
进一步探索