把液体活组织检查放在扎实的基础上:从一毫升血液诊断癌症
血液检测简单、无创、经济可行,有望成为癌症诊断的下一个重要里程碑。然而,这些被称为液体活检的检测目前还不够可靠,无法广泛应用。魏茨曼科学研究所(Weizmann Institute of Science)开发的一种新的多参数方法可能会导致一种血液测试,它将以前所未有的准确性诊断癌症。这项研究今天发表在自然生物技术.
“目前临床上可用来检测和诊断癌症的许多常规方法都是侵入性的,令人不快,”领导该研究小组的魏茨曼免疫和再生生物学部门的Efrat Shema博士解释说。通过针、内窥镜或手术获取活检样本可能会很痛苦,有时还会有风险,而MRI或PET扫描等成像方法需要昂贵、笨重的设备,而这些设备并不是普遍可用的。有效的血液测试癌症筛查或者诊断可以提供一个有吸引力的选择。
Vadim Fedyuk说:“消除不适意味着人们不太可能避免检查,更有可能更早地发现他们的癌症。”他和他的研究生Nir Erez一起领导了这项研究。
使用液体活组织检查诊断癌症的想法源于这样一个事实,即血液中含有自由漂浮的DNA和蛋白质,这些蛋白质是由健康人体内死亡的血细胞脱落的癌症患者死亡的肿瘤细胞。“细胞破坏的一些副产物,包括癌症DNA和蛋白质,被倾倒到血液中,我们知道如何收集和分析它们,”Shema说。
一些用于癌症的血液检测已经处于发展的晚期,但大多数都存在缺陷,可能会限制它们的使用。当第一次这样的测试被开发出来时,他们寻找癌症的遗传迹象,即突变,但这些可能很难确定,因为突变的片段只占自由循环DNA的一小部分。此外,这些突变并不一定会导致癌症,健康的人也可能存在。最近,液体活检方法已经开始依赖于表观遗传学,即不涉及DNA突变的细胞基因组的修改——例如,附着在DNA分子上的化学标签,改变基因表达。这些方法也遇到了麻烦,要么是因为它们需要大量的血液,要么是因为它们寻找的是单一的表观遗传变化,而不能产生足够可靠的结果。
在这项新研究中,Shema开始重新思考这种表观遗传分析,旨在开发一种依赖于少量血液样本来评估多个表观遗传参数的分析。她在哈佛医学院(Harvard Medical School)和布罗德研究所(Broad Institute)做博士后研究期间开发了一种对单个分子进行成像的方法。该方法使得使用荧光显微镜仅用非常少量的原材料就可以实现精确的表观遗传图谱。例如,它可以用来观察核小体上的表观遗传标记,即包裹在蛋白质“线轴”周围的DNA片段。当细胞被破坏时,这些核小体可能会像漂浮物一样流入血液,所以Shema推断,可以通过分析血液中发现的数百万个核小体来检测癌症。
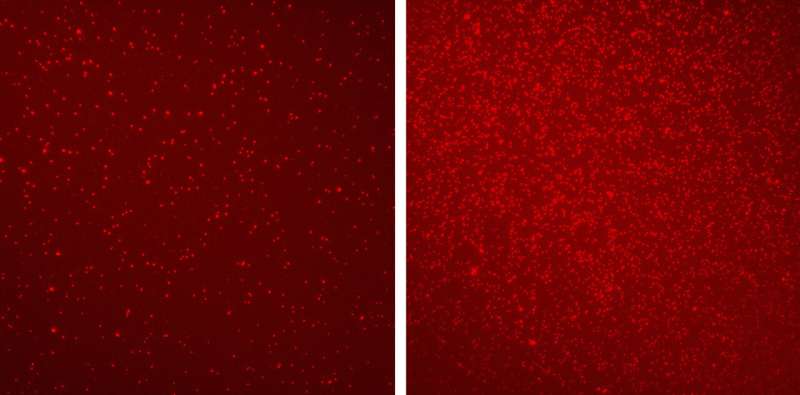
Fedyuk和Erez及其同事使用Shema的单分子成像方法,将30名健康个体的血液中的核小体与60名不同阶段的结直肠癌患者的血液中的核小体进行了比较。他们发现这两组的核小体具有截然不同的表观遗传标记模式。这项分析涵盖了与癌症相关的六种不同的表观遗传修饰,以及各种其他癌症指标,包括来自死亡肿瘤的蛋白质片段,这是传统技术无法检测到的。
接下来,科学家们与耶路撒冷希伯来大学拉卡物理研究所的盖伊·罗恩教授合作,将他们所揭示的癌症分子生物学与人工智能算法,将机器学习应用于大型数据集从两组中得到。研究人员不仅对所有这些癌症标志物进行了分析,还对它们之间的组合和关系进行了分析。为了确保他们的发现不局限于结直肠癌,科学家们还应用他们的技术比较了健康志愿者和10名胰腺癌患者的血液核小体。
Shema说:“我们的算法可以在这种类型的研究中以创纪录的确定性水平区分健康组和患者组之间的差异,精确度达到92%。”科学家们称这项新技术为EPINUC,是“等离子体分离核小体的表观遗传学”的首字母缩写。
如果有涉及更多患者的研究支持,这些发现可能会导致多参数血液测试用于检测和诊断癌症,使用不到1毫升的血液。在未来,由于分析中揭示的细节水平,这种血液测试的结果也可能通过为每个患者提出最佳治疗方案来推进个性化医疗。
Shema总结道:“我们已经成功地证明了我们的方法的概念,现在需要在临床试验中得到证实。在未来,我们的多参数方法不仅可以诊断各种癌症,还可以诊断在血液中留下痕迹的其他疾病,如自身免疫性疾病或心脏病。”
更多信息:Efrat Shema,用于癌症诊断的等离子体分离核小体的多重单分子表观遗传学分析,自然生物技术(2022)。DOI: 10.1038 / s41587 - 022 - 01447 - 3.www.nature.com/articles/s41587 - 022 - 01447 - 3