RAF1。信贷:CNIO
肿瘤的主要挑战之一是对喀斯特致癌基因药物的开发。这些oncogenes-genes致癌当mutated-are负责四分之一的人类癌症,包括三个死亡率最高的肿瘤类型:肺腺癌、结直肠癌和胰腺导管腺癌。
虽然喀斯特wigler致癌基因已经发现的马里亚诺·Barbacid集团四十年前,第一个药物对them-Sotorasib Amgen-has被FDA批准的只有一年前。这个里程碑是一样重要,Sotorasib行为只对肿瘤携带多个突变之一出现在喀斯特致癌基因及其临床影响是有限的。此外,这种药物产生耐药性患者治疗几个月后。
RAF1和肺腺癌
除了对喀斯特药物的发展,目前最活跃的研究领域之一,旨在识别蛋白的抑制剂,如RAF1,负责传输喀斯特致癌信号。
在这方面,wigler Mariano Barbacid的实验室,利用转基因小鼠模型,忠实地概括人类肺腺癌,四年前证明消除大多数肿瘤的RAF1蛋白诱导回归没有明显的毒性作用。
目标:降低RAF1
这些观察结果产生巨大的兴趣发现药物降解RAF1的能力。今日发布的一项新研究的结果分子细胞,打开机会之窗设计RAF1降能器,单独或结合喀斯特抑制剂,可以生成一个重要的患者的治疗效果肺腺癌由喀斯特致癌基因。
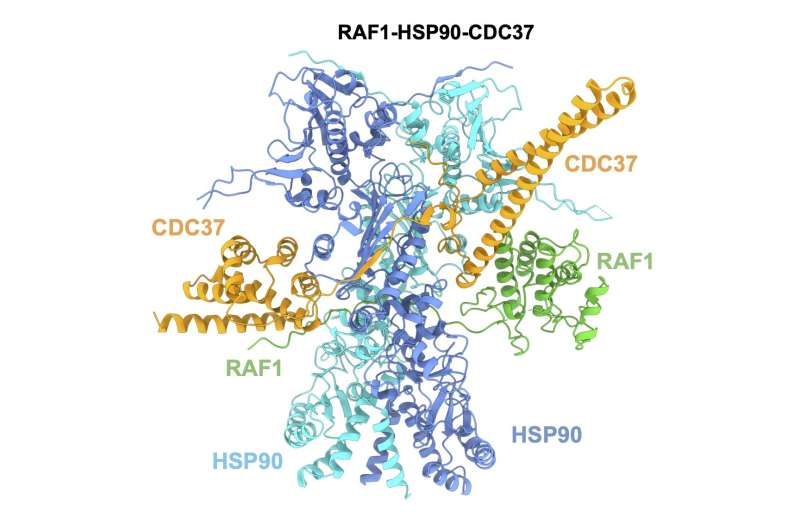
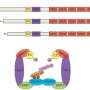
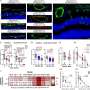
三维结构的测定RAF1这个目标是一个关键的一步,因为它揭示了部分的蛋白质药物化学锚定,并促进其破坏的细胞机制(细胞清洗机制,降低缺陷或无用的蛋白质)。
主要研究人员负责这项工作是Sara Garcia-Alonso CNIO,巴勃罗台面,从分子生物学和结构组哥本哈根大学。
“这项研究提供的信息打开了一系列发展中药物可以降低RAF1的选择,“Garcia-Alonso说。“一个机会之窗现在开放设计RAF1降能器与一个重要的肺癌患者的治疗效果腺癌由喀斯特致癌基因。”
更多信息:Sara Garcia-Alonso et al, RAF1-HSP90-CDC37复杂结构揭示了RAF1监管的基础上,分子细胞(2022)。DOI: 10.1016 / j.molcel.2022.08.012
期刊信息:分子细胞
所提供的西班牙国家癌症研究中心