研究探讨了非编码基因组在神经发育障碍中的变化的影响

人类基因组中只有不到2%是由编码蛋白质的基因组成的,其余98%是非编码的,参与调节基因表达。科学家们在基因组编码区域发现了许多直接关闭基因并导致疾病的变化,现在他们发现基因组非编码区域的变化也会产生临床后果。
在一项新的研究中,麻省理工学院布罗德研究所、哈佛大学和马萨诸塞州总医院(MGH)的研究人员发现,在一种名为mef2c的基因附近的非编码区域存在结构变异,这是一种与癌症有关的转录因子神经发育障碍(ndd) -可以模拟基因本身变化的影响。
他们的论文发表于10月24日美国人类遗传学杂志该研究首次描述了人类神经元细胞系中编码和非编码MEF2C变异的长期影响,并表明间接和直接的基因破坏都可能产生类似的下游影响。
“这是一个很好的概念模型,说明了不同的编辑、不同的调控机制和不同的突变类型如何真正影响同一个基因,并在基因中产生一系列不同的后果人类健康该论文的高级作者迈克尔·塔尔科夫斯基(Michael Talkowski)说,他是布罗德医学与人口遗传学项目和斯坦利精神病学研究中心的研究所成员,也是麻省总医院基因组医学中心主任和神经内科教员。
在编码基因组之外
已经证实,改变MEF2C的结构变异会增加一个人患ndd的几率,包括自闭症谱系障碍、发育迟缓、智力残疾、癫痫等。这种基因本身对改变是不耐受的——如果一个人只继承了一个改变的基因副本,他们的细胞就不能产生足够的MEF2C蛋白(一种称为单倍不足的现象),这就增加了NDD的几率。
科学家们已经能够在小鼠模型中看到单倍不足的影响,其中失去一个MEF2C副本会改变大脑发育并降低神经元中的电化学活性。塔尔科夫斯基和他的团队,由哈佛大学博士生Kiana Mohajeri和神经病学讲师Rachita Yadav领导,想要证明这些发现可以被复制人类细胞.
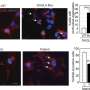
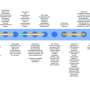
研究小组首先评估了来自CRISPR/Cas9编辑的诱导多能干细胞的神经元细胞系中MEF2C及其周围的不同变化对模拟6种不同结构变体的影响。他们有了一个意想不到的发现:在MEF2C附近的非编码DNA的近端环边界发生特定改变,但在基因中没有直接改变的细胞仍然产生较低水平的MEF2C蛋白,并难以传导电化学信号。非编码基因组的改变似乎恰好反映了基因直接改变的影响。
Talkowski说:“在MEF2C周围的基因组被重新排列的情况下,我们发现了相当于单倍缺陷的情况。”“这导致了一种假设,即三维组织被破坏了,导致了一些看起来像单倍缺陷的东西。”
不可预知的结论
研究小组开始系统地探索MEF2C周围非编码区域的某些改变是否会与基因变化产生类似的下游影响。他们研究了包括MEF2C在内的拓扑关联域(TAD)内的变化。TADs是包含基因以及非编码基因调节DNA元件,这些元件被认为是相互作用的,使得MEF2C周围的区域可能成为科学家们正在寻找的非编码基因变化的热点。
他们发现,携带crispr诱导的MEF2C变化的神经元细胞系显示出与神经发育途径相关的基因表达较低,细胞间传递电信号的能力也较低。
研究非编码基因组的变化并不那么简单。研究小组最初认为,破坏MEF2C的tad的一个边缘——一个称为远端环边界的区域——将产生与直接改变MEF2C相同的效果。但这些干扰似乎并没有改变神经元的功能。
只有当他们破坏了MEF2C的tad另一端的边界(即所谓的近端环边界)时,研究小组才能模拟MEF2C突变的影响。携带这种干扰的神经元很难将信号传递给它们的邻居。
虽然这一发现证实了研究人员的怀疑,即不同的MEF2C损失机制可能对大脑产生类似的影响细胞水平上这项研究还提出了一系列关于非编码DNA的改变如何导致某些疾病的新问题。
“游戏中存在不同程度的复杂性基因表达这项研究的共同第一作者亚达夫说。
这篇论文探讨了一些尚未被研究的基因被破坏的方式,但由于基因调控和表达之间的关系是多层次的,科学家需要更深入地挖掘,以更好地理解将非编码基因组的变化与细胞和临床结果联系起来的机制。
塔尔科夫斯基说:“这些复杂的神经发育基因的调控非常复杂,我们已经通过分析分析了其中的一些片段,但我们甚至还没有接近于捕捉到全貌。”
进一步探索