基因矫正是铁储存病的一种可能疗法

遗传性原发性血色素沉着症是欧洲最常见的先天性代谢错误之一。在这种疾病,也被称为铁储存病,身体铁超载。过量的铁积聚在器官和组织中,导致肝脏、心脏、胰腺、脑垂体和关节的缓慢进行性损伤。这可能导致心肌的变化(心肌病)或糖尿病(支气管糖尿病),甚至导致肝组织瘢痕(肝硬化)和肝癌。
原因是遗传缺陷这扰乱了监管铁经小肠粘膜吸收。汉诺威医学院(MHH)消化病学、肝病学和内分泌学教授迈克尔·奥特(Michael Ott)和西蒙·克罗斯(Simon Krooss)领导的研究小组现在已经找到了一种在靶向治疗的帮助下治疗这种遗传性疾病的方法基因修正.这项工作已发表在杂志上自然通讯.
铁吸收控制缺陷
奥特教授说:“在大多数情况下,铁储存病是由于位于6号染色体上的血色沉着病基因HFE的缺陷。”它只发生在从父母双方遗传了这种缺陷的人身上,即没有“健康”基因来补偿的人。在80%以上的患者中,在HFE基因的两个副本中都发现了一种被称为C282Y突变的变化。这导致一种氨基酸的替换。一种蛋白质组成部分——HFE蛋白。
结果,HFE蛋白失去了控制铁吸收到细胞的能力肠细胞.为了排空体内储存的铁,使体内铁浓度正常化,患者必须接受终生的采血手术。“这很有压力,而且并不适用于每个人,”这位肝病学家指出。直接将铁结合在体内从而中和铁的药物也不理想,因为有强烈的副作用。
细胞启动修复程序
因此,MHH的研究人员正在寻求一种不同的方法。他们利用人体自身的修复机制来修复有缺陷的HFE基因。在被称为“基因剪刀”的CRISPR/Cas技术和配套的生物技术工具的帮助下,他们专门改变了突变HFE基因中一个微小的有缺陷的组成部分。
在技术术语中,这个过程被称为碱基编辑。这种基因修复的特殊之处在于:基因剪刀的使用方式不像经典应用中那样简单地将DNA双链完全剪断在所需的位置。这位医生兼科学家说:“双链断裂总是带有一定的不必要突变风险。”另一方面,使用基编辑,两条单链彼此分离,只改变其中一条。
“因此,细胞会自动启动其自然修复程序,并将正确的核苷酸合并到第二条链中,这样C282Y突变就会在整个双链中消失,”克罗斯博士解释道。
小鼠模型:血液中铁含量显著下降
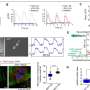
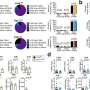
研究小组在小鼠模型中研究了这种生物技术伎俩。单次注射,基因矫正率为12%。该研究的第一作者Alice Rovai博士说:“这是一个巨大的成功,因为如果5%的细胞具有正确的基因,大多数遗传疾病就已经可以得到控制。”在干预四个月后,血液中的铁含量已经显著下降。此外,研究人员预计12个月后铁含量会进一步降低。“修复系统是缓慢的,所以需要时间让更多的肝细胞进行基因校正。”
但研究小组想要更多。到目前为止,他们已经将CRISPR/Cas系统与分子工具打包在一种所谓的病毒载体(也被称为基因出租车)中,并通过注射到小鼠体内。在下一步中,研究人员希望只发送碱基编辑系统的mRNA蓝图——类似于针对SARS-CoV-2冠状病毒的mRNA疫苗。
克罗斯博士说:“这更安全、更有效,因为我们可以不使用病毒载体,并可能将成功率提高到30%至40%。”如果这一研究成功,并且应用于人类,那么在未来,一次注射就可以拯救因肝癌和器官切除而严重患有血色素沉着症的人。
“注射而不是移植,”肝脏研究人员奥特说。此外,碱基编辑可能是许多先天性疾病的治疗选择,其原因是单个缺陷基因。
进一步探索