研究人员致力于研究Stargardt病的一种新病因
通过使用一种新的基于干细胞的皮肤细胞模型,科学家们发现了stargardt相关的ABCA4基因突变影响眼睛中一层叫做视网膜色素上皮(RPE)的细胞的第一个直接证据。这一发现指向了对Stargardt疾病进展的新认识,并提出了目前缺乏治疗的疾病的治疗策略。这项研究在国家眼科研究所(NEI)进行,它是国家卫生研究院的一部分。研究结果于今天在网上发表干细胞报告.
NEI主任Michael F. Chiang博士说:“这种新模式将加速Stargardt病的治疗方法的发展。“我们缺乏治疗这种疾病的方法,部分原因是它很罕见。从理论上讲,这个模型为研究创造了无限的人体细胞供应。”在美国,每1万人中就有1人患有Stargardt
Stargardt病会导致中枢神经的渐进性丧失夜视.视力下降与RPE中富含脂质的有毒沉积有关,其主要作用是支持和滋养视网膜的感光感光器。在正常情况下,ABCA4基因会产生一种蛋白质来阻止这种毒素的积聚。先前的研究表明,Stargardt病是由ABCA4基因的各种突变引起的。已知超过800个ABCA4突变与广泛的Stargardt病表型相关。
RPE支持光感受器的一种方式是摄取它们耗尽的外节段,这使细胞保持修剪和健康。在Stargardt病中,许多科学家认为RPE细胞在摄入外部节段时获得毒性副产物后死亡,这反过来导致光感受器死亡和视力丧失.
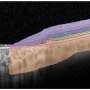
目前对Stargardt病的大部分了解都是通过研究小鼠模型获得的,由于该疾病在人类中的广泛遗传变异性,这种模型固有地受到限制。通过RPE的人类模型,NEI研究人员能够确定ABCA4基因突变是否独立于光感受器直接影响RPE。
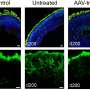
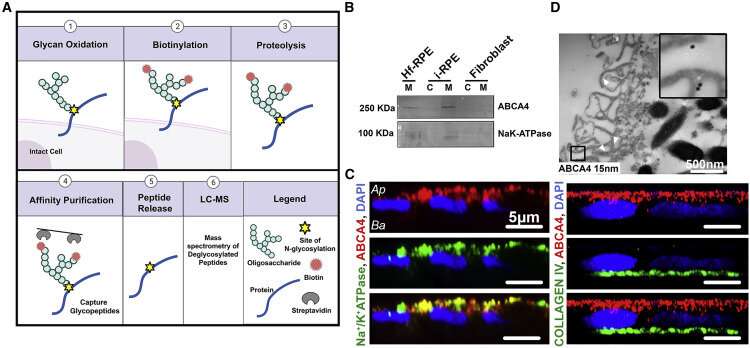
为了开发这个模型,研究人员采用了皮肤细胞从Stargardt患者中提取,将其转化为干细胞,然后诱导干细胞分化为RPE细胞。研究人员检测了患者来源的RPE,在RPE细胞膜上检测到了ABCA4蛋白。他们利用基因编辑技术CRISPR/Cas9来生成缺乏ABCA4的患者源性RPE,即ABCA4敲除,从而探索ABCA4在RPE发育中的作用。他们发现ABCA4的缺失并不影响患者源性RPE的成熟。
然而,当缺乏ABCA4的RPE暴露于正常(野生型)光感受器外节段时,RPE细胞内积累了脂质沉积。
进一步的ABCA4敲除试验表明,RPE脂质代谢有缺陷,消化光感受器外节段的能力受损,导致脂质沉积在RPE细胞中。
这是首次报道在没有暴露于ABCA4突变光感受器外节段的情况下,人RPE中ABCA4功能的丧失与细胞内脂质沉积有关。随着时间的推移,这些脂质沉积可能导致RPE萎缩,导致光感受器变性。
“我们的报告为靶向RPE的基因治疗方法提供了指导,”该研究的首席研究员Kapil Bharti博士说,他是NEI眼科和干细胞转化研究部的高级研究员。“我们的数据表明,除了纠正光感受器中ABCA4功能的丧失,基因疗法还需要针对RPE细胞。”
这项研究是NEI为解决用于研究Stargardt病的患者来源干细胞系有限的可用性而进行的更大努力的一部分。为了克服这一障碍,NEI从具有不同ABAC4突变的患者中启动了STGD1-iPSC银行项目。这些细胞将提供给整个社会进行机制和基因型-表型研究。