新发现的蛋白质驱动乳腺癌茎干和转移

西北医学院的一项研究发现了一种导致乳腺癌茎干和转移的蛋白质。这项由机器学习实现的研究结果发表在该杂志上eLife.
在许多癌症中,具有干细胞-祖细胞特性的肿瘤启动细胞被认为是癌症发展和转移再生的必要条件。然而,根据该研究的资深作者、医学博士、血液学和肿瘤学部门药理学和医学教授刘惠平(音译)的说法,阐明潜在的分子网络一直具有挑战性。
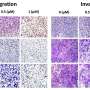
结合机器学习在实验研究中,Liu和她的团队证明了蛋白膜CD81与另一个先前确定的肿瘤起始细胞标志物CD44相互作用,促进三阴性乳腺癌(TNBC)的肿瘤细胞簇形成和肺转移。
刘说:“这些发现拓宽了对乳腺癌细胞干性分子调节网络的认识,可能对治疗靶向有重要意义。”
TNBC占新诊断乳腺癌病例的10%至15%,具有高度转移性,长期生存率低。TNBC转移到内脏器官,如肺、肝和脑。而细胞机制导致肿瘤细胞扩散的原因仍然是未知的,蛋白质网络提供线索,刘说。
“我们知道蛋白质的功能它们的网络是直接调节细胞表型和性能的骨干的一部分,”她说。
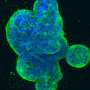
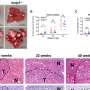
在之前的研究中,Liu的实验室发现,乳腺肿瘤起始细胞标志物CD44介导循环肿瘤细胞(CTC)簇(两个或多个细胞)的形成,其在此类簇中的富集表达预示着乳腺癌患者,尤其是TNBC患者的总体生存期较差。CTC集群在播种转移方面的效率比单个CTC高100倍。
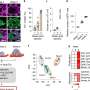
在这项研究中,为了描述CD44的蛋白质网络,科学家们发现CD44与CD81结合以协调膜定位,并且两者都是最佳自我更新、CTC簇形成和转移所必需的,强调了CD44和CD81在细胞中不可或缺的功能细胞粘附以及细胞间相互作用在转移中的作用。
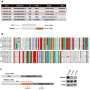
为了证明两者之间的合作关系膜蛋白,科学家们使用了一种复杂的、基于计算算法的蛋白质结构建模(机器学习)来预测界面区域和氨基酸残基参与蛋白质相互作用。然后采用实验方法验证CD44和CD81界面的相互作用。
“机器学习和深度学习已经改变了蛋白质结构建模,极大地促进了对TNBC和其他转移性疾病的分子理解和治疗发展,”刘说。
Liu补充说,机器学习和深度学习促进的研究不仅将成倍地扩大模拟治疗筛选,以获得最佳疗效和最低毒性,而且还将使个性化医疗更容易实现和负担得起。
她说:“我们的下一步是将CTC生物标志物分析与个性化靶向治疗开发结合起来。”
进一步探索