定位BRCA基因突变以更好地治疗卵巢癌
BRCA1和BRCA2基因的突变会显著增加患某些癌症的风险,如卵巢癌、乳腺癌、胰腺癌和前列腺癌。BRCA1和BRCA2基因的遗传比例分别为每400人和每800人中就有1人继承这两种基因。
2016年,一种新的药物PARP抑制剂被发现对BRCA突变相关的肿瘤非常有效。然而,几乎一半的卵巢癌女性在五年内会复发。
一个由日内瓦大学(UNIGE)、日内瓦大学医院(HUG)、里昂中心Léon Bérard、居里研究所、法国合作小组ARCAGY- GINECO和欧洲财团ENGOT领导的国际团队对该疾病进行了研究基因数据奥拉帕尼是一种PARP抑制剂,添加到贝伐珠单抗中,贝伐珠单抗已经被用于治疗卵巢癌。
研究人员发现PARP抑制剂的成功取决于基因突变的精确位置。这些结果可以在杂志上读到肿瘤学年鉴,证明了肿瘤学中非常高精度的医学是可能的。
BRCA1和BRCA2基因编码的蛋白质涉及DNA双链断裂的修复,这是一种特别严重的DNA损伤形式,因此在维持细胞基因组的稳定性方面发挥着重要作用。当它们发生突变时,细胞修复受损DNA的能力就会下降,这一现象促进了癌症的发展。
Intidhar Labidi-Galy博士指出:“由此产生的癌症具有特别强的侵略性。”他是UNIGE医学院肿瘤-血液学转化研究中心和医学系的研究员,也是日内瓦大学医院肿瘤科的专职医师,也是该研究的通讯作者。“卵巢癌的预后通常很差,是携带这两种基因之一突变的女性最常见的癌症之一基因."
最近PARP蛋白抑制剂(包括奥拉帕尼)的出现是治疗方面的一个重大进展。这是第一次提出一种总体生存期显著增加的治疗方法。“但是,尽管之前的研究表明PARP抑制剂对BRCA1和BRCA2相关的癌症非常有效,但几乎一半的患者的癌症复发。为什么会发生这种事?这就是我们想要破译的,”她补充道。
药效不均匀的药物
该研究团队对参加PAOLA-1 III期临床试验的233名患者的BRCA1和BRCA2突变进行了详细分析。PAOLA-1是奥拉帕尼与抗血管生成药物贝伐珠单抗联合使用的一项上市前研究,该药物已用于治疗卵巢癌症.病人患了晚期疾病卵巢癌并且所有人都携带BRCA1基因突变(159例)或BRCA2基因突变(74例)。
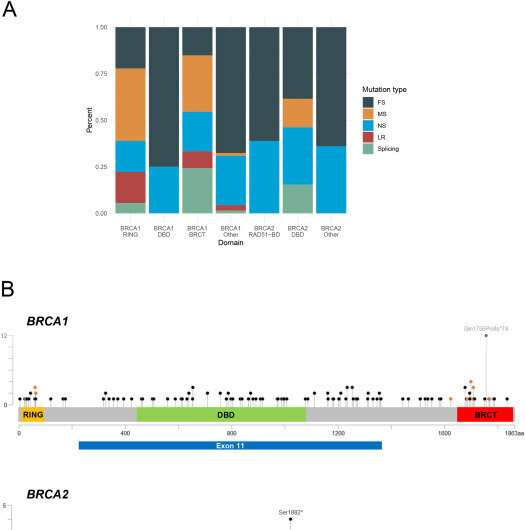
“我们决定通过详细描述所涉及的突变来提高我们分析的准确性,特别是区分那些对药物敏感的人和那些对药物不敏感的人的区别,”肿瘤学教授伊莎贝尔·雷-科quard解释说,她在Léon Bérard中心(隶属于国家抗癌中心联合会(CLCC) -独癌网络)和里昂克劳德·伯纳德大学(Claude Bernard University)工作,该中心负责监督这项工作。“差异来自于基因突变的定位:如果突变位于dna结合区域,药物实际上更有效。”DNA结合结构域是能够与DNA结合的蛋白质基序,参与基因表达的调控。
“PARP抑制剂的目的是在突变细胞中制造DNA断裂的积累,导致它们在形成恶性肿瘤之前迅速死亡,”居里研究所的执业医生、该文章的共同第一作者曼纽尔·罗德里格斯博士解释说。“看来是这样突变在dna结合区域加速这一过程,并显著增加的有效性药物.当突变涉及到基因的其他功能部分时,情况就不那么严重了。”
国际学术研究
这些结果强调了肿瘤学需要非常高精度的医学。“不可否认的是,这类药物对大部分患者都非常有效——有些甚至似乎完全治愈了,而在几年前,他们注定要失败,在进行分析时,有90%的BRCA1基因dna结合域突变的人没有复发。但重要的是要了解药物的确切作用机制,并根据患者及其肿瘤的遗传特征来改进治疗方法。在这里,突变的位置是关键,”Isabelle Ray-Coquard说。
这项国际学术研究是同类研究的首次,是精确肿瘤学方法的一部分,在这种方法中,解码患者和肿瘤的基因组是必不可少的。后者可以通过开发特定的抑制剂更好地靶向病变细胞,这也将有助于限制副作用。