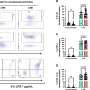
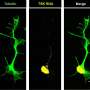
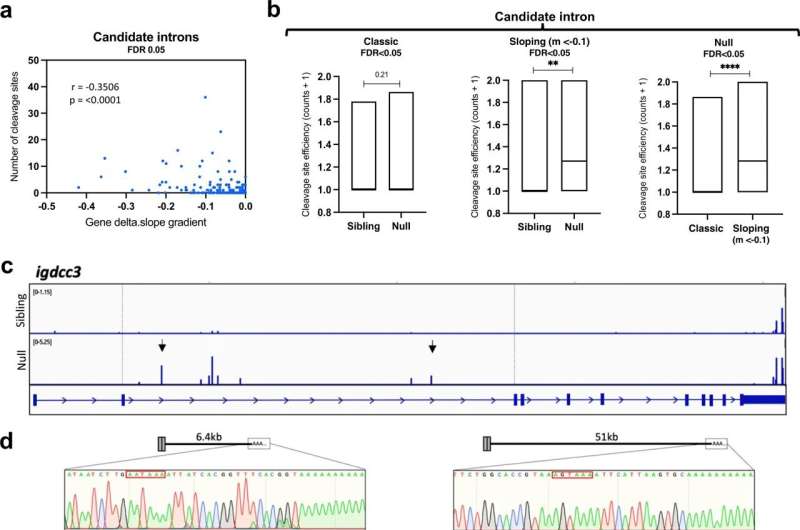
 PreT-IR转录本在sfpq缺失的神经元中发生裂解/聚腺苷酸化和神经突定位。gydF4y2Ba一个gydF4y2BaRNAseq读空斜率梯度与倾斜ir转录本内含子切割位点数量之间的相关性。双尾Pearson相关系数,r:−0.3506,gydF4y2BapgydF4y2Ba< 0.0001 (gydF4y2BangydF4y2Ba= 247个倾斜ir转录本,FDR < 0.05)。gydF4y2BabgydF4y2Ba经典解理位点利用效率(左;(gydF4y2BangydF4y2Ba= 107, FDR < 0.05)),坡度(Middle;(gydF4y2BangydF4y2Ba= 37岁gydF4y2Ba米gydF4y2Ba<−0.1,FDR < 0.05)) ir转录本。(右)null样本中经典和倾斜ir转录本之间保留内含子的切割位点使用效率。浮动条形图,中间表示中位数,上限和下限表示最大值和最小值。双尾Mann-Whitney检验。(左)gydF4y2BapgydF4y2Ba= 0.21,(中)**gydF4y2BapgydF4y2Ba0.0076,(右)****gydF4y2BapgydF4y2Ba< 0.0001 (gydF4y2BacgydF4y2Ba) 3'mRNAseq的位置沿簇读取gydF4y2Baigdcc3gydF4y2Ba在24个hpf的兄弟缺失胚胎RNA样本中,表明了卵裂和多聚腺苷酸化的位点。峰高表示该样品转录物中每个裂解位点的相对使用情况。虚线表示内含子-2。黑色箭头表示3'RACE瞄准的峰值。gydF4y2BadgydF4y2Ba的3'RACE验证gydF4y2Baigdcc3gydF4y2Ba3’mrnaseq结果为(gydF4y2BacgydF4y2Ba)在空轴突中。产物测序显示末端内含子序列包含PAS一致序列(红框)和PolyA尾巴的开始。(左)外显子1-2 + 6.5 kb内含子-2和polyA。(右)外显子1-2 + 51 kb内含子-2和polyA。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba共聚焦z-投影(10 μm) 1dpf(受精后1天/24hpf)gydF4y2BasfpqgydF4y2Ba兄弟姐妹(gydF4y2BaegydF4y2Ba) & null (gydF4y2BafgydF4y2Ba)胚胎轴突,和gydF4y2Baigdcc3gydF4y2BaIR和PreT-IR转录本。探针设置目标5 ' -most(红色)或3 ' -most(洋红色)10 kb的内含子2。轴突在小囊泡前纵向延伸。星号:由内含子-2探针组标记的轴突rna。箭头:仅由5 '内含子-2探针组标记的轴突rna。RNA点也存在于轴突周围的神经元细胞体中。比例尺为10 μm。gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba轴突中5 '和3 '内含子-2点位的定量分析gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba).每个数据点代表一个不同的胚胎。gydF4y2BaNgydF4y2Ba= 10个兄弟胚胎和10个无效胚胎。带有Welch修正的双尾未配对t检验,****gydF4y2BapgydF4y2Ba< 0.0001。信贷:gydF4y2Ba自然通讯gydF4y2Ba(2022)。DOI: 10.1038 / s41467 - 022 - 34331 - 4gydF4y2Ba
PreT-IR转录本在sfpq缺失的神经元中发生裂解/聚腺苷酸化和神经突定位。gydF4y2Ba一个gydF4y2BaRNAseq读空斜率梯度与倾斜ir转录本内含子切割位点数量之间的相关性。双尾Pearson相关系数,r:−0.3506,gydF4y2BapgydF4y2Ba< 0.0001 (gydF4y2BangydF4y2Ba= 247个倾斜ir转录本,FDR < 0.05)。gydF4y2BabgydF4y2Ba经典解理位点利用效率(左;(gydF4y2BangydF4y2Ba= 107, FDR < 0.05)),坡度(Middle;(gydF4y2BangydF4y2Ba= 37岁gydF4y2Ba米gydF4y2Ba<−0.1,FDR < 0.05)) ir转录本。(右)null样本中经典和倾斜ir转录本之间保留内含子的切割位点使用效率。浮动条形图,中间表示中位数,上限和下限表示最大值和最小值。双尾Mann-Whitney检验。(左)gydF4y2BapgydF4y2Ba= 0.21,(中)**gydF4y2BapgydF4y2Ba0.0076,(右)****gydF4y2BapgydF4y2Ba< 0.0001 (gydF4y2BacgydF4y2Ba) 3'mRNAseq的位置沿簇读取gydF4y2Baigdcc3gydF4y2Ba在24个hpf的兄弟缺失胚胎RNA样本中,表明了卵裂和多聚腺苷酸化的位点。峰高表示该样品转录物中每个裂解位点的相对使用情况。虚线表示内含子-2。黑色箭头表示3'RACE瞄准的峰值。gydF4y2BadgydF4y2Ba的3'RACE验证gydF4y2Baigdcc3gydF4y2Ba3’mrnaseq结果为(gydF4y2BacgydF4y2Ba)在空轴突中。产物测序显示末端内含子序列包含PAS一致序列(红框)和PolyA尾巴的开始。(左)外显子1-2 + 6.5 kb内含子-2和polyA。(右)外显子1-2 + 51 kb内含子-2和polyA。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba共聚焦z-投影(10 μm) 1dpf(受精后1天/24hpf)gydF4y2BasfpqgydF4y2Ba兄弟姐妹(gydF4y2BaegydF4y2Ba) & null (gydF4y2BafgydF4y2Ba)胚胎轴突,和gydF4y2Baigdcc3gydF4y2BaIR和PreT-IR转录本。探针设置目标5 ' -most(红色)或3 ' -most(洋红色)10 kb的内含子2。轴突在小囊泡前纵向延伸。星号:由内含子-2探针组标记的轴突rna。箭头:仅由5 '内含子-2探针组标记的轴突rna。RNA点也存在于轴突周围的神经元细胞体中。比例尺为10 μm。gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba轴突中5 '和3 '内含子-2点位的定量分析gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba).每个数据点代表一个不同的胚胎。gydF4y2BaNgydF4y2Ba= 10个兄弟胚胎和10个无效胚胎。带有Welch修正的双尾未配对t检验,****gydF4y2BapgydF4y2Ba< 0.0001。信贷:gydF4y2Ba自然通讯gydF4y2Ba(2022)。DOI: 10.1038 / s41467 - 022 - 34331 - 4gydF4y2Ba
伦敦国王学院精神病学、心理学和神经科学研究所(IoPPN)的一项新研究发现了神经退行性疾病肌萎缩性侧索硬化症(ALS)的一个新标志,揭示了这种疾病可能的分子触发因素。gydF4y2Ba
这项研究发表在gydF4y2Ba自然通讯gydF4y2Ba研究人员发现,运动神经元中RNA处理蛋白SFPQ的缺失会导致它们的“死背”。这包括轴突的破坏(负责连接和与身体其他部分通信的神经元的一部分),然后,细胞体死亡。gydF4y2Ba
利用斑马鱼,研究人员探索了sfpq耗尽的运动神经元在退化之前发生了什么。他们发现,通常由SFPQ调控的草稿信使rna (mRNAs)只被部分编辑并被截断。令他们惊讶的是,这些有缺陷的mrna并没有被降解,而是稳定地定位在轴突上,在轴突上积累并干扰正常功能。这是第一个显示蛋白质缺失引发轴突分子事件级联的研究。gydF4y2Ba
由于SFPQ的丧失与渐冻症密切相关,作者从斑马鱼中获得了他们的发现,并分析了渐冻症患者的数据。他们发现不寻常的缺陷mrna在患者神经元中富集,这表明这些轴突mrna是导致疾病退化的原因之一。gydF4y2Ba
该研究的主要作者、国王学院IoPPN发育神经生物学教授Corinne Houart说:“在斑马鱼SFPQ突变体和人类ALS神经元中发现相同的mRNA异常,为理解神经退行性过程开辟了一条新途径。我们的研究结果和国际同事的研究结果表明,控制轴突中的mRNA多样性对神经元健康至关重要。发现受衰老或神经系统疾病影响的神经元mRNA调控的局部变化,将为解决这些问题提供巨大进展。”gydF4y2Ba
据估计,英国同时约有5000人患有ALS。确诊后的平均生存时间为2至5年,目前还没有有效的治疗方法。这一发现为ALS患者开辟了一条可能的治疗新途径,旨在恢复神经元中的SFPQ功能。这样做,就可以防止它们的退化。gydF4y2Ba
该研究的第一作者理查德·泰勒博士说:“我们惊讶地发现,这些在SFPQ功能丧失时形成的异常mrna在细胞核中并没有降解。相反,与教条相反,它们似乎逃脱并专门定位于轴突。如果翻译,它们在RNA水平或蛋白质水平上的影响可能会损害轴突的完整性,并可能启动ALS神经元中观察到的退化的‘死背’序列。”gydF4y2Ba
研究人员现在将重点转向确定这些缺陷mrna在ALS患者轴突中具有毒性的机制,并将研究将正常SFPQ引入患者ipsc衍生的退化神经元的效果。gydF4y2Ba
更多信息:gydF4y2Ba在SFPQ null驱动的神经退行性变中,过早终止的内含子保留mrna侵入轴突,是ALS的标志,gydF4y2Ba
自然通讯gydF4y2Ba(2022)。gydF4y2Ba
DOI: 10.1038 / s41467 - 022 - 34331 - 4gydF4y2Ba
引用gydF4y2Ba:研究人员揭示了一个新的ALS标志,揭示了神经退行性变的可能触发因素(202022,11月22日),检索自2023年1月6日//www.puressens.com/news/2022-11-reveal-als-hallmark-trigger-neurodegeneration.htmlgydF4y2Ba
这份文件受版权保护。除为私人学习或研究目的而进行的公平交易外,未经书面许可,不得转载任何部分。内容仅供参考之用。gydF4y2Ba