血液凝固研究为败血症带来了希望
英国伯明翰大学的研究人员发现了致病性血液凝固(血栓形成)中血小板激活的一种新机制,现在他们将注意力转向败血症。
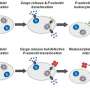
由伯明翰血小板组的Julie Rayes副教授和Martina Colicchia博士确定,并在最近的一篇论文中描述血,这个之前未知的轴包括血小板受体糖蛋白I α (GPIbα)和抗微生物蛋白S100A8/A9,它从激活中释放免疫细胞.
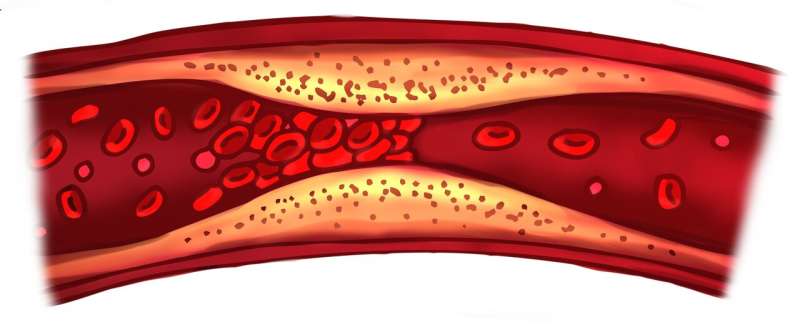
这种机制不会被目前用于治疗动脉血栓的经典抗血小板药物阻断,并且与描述良好的限制损伤后失血的“凝血级联”不同。
Rayes博士解释说:“当血栓在血管损伤部位形成时,可以看到两种主要的血小板群。高度活化和聚集的血小板位于凝块的核心,而促凝血小板存在于核心周围的壳层,支持稳定凝块的纤维蛋白的生成。
“S100A8/A9-GPIbα轴不诱导血小板聚集但它确实能诱导促凝血小板的形成并加速纤维蛋白活化和血栓形成。这条轴可能与先天免疫细胞和血小板的激活在凝血中起关键作用的疾病状态更相关。”
高水平的S100A8/A9在血栓炎性疾病包括血液中可见心肌梗死(MI),深静脉血栓形成(DVT)和感染,如COVID-19和败血症,它们的存在与血栓并发症相关,并对患者造成更糟糕的结果。
研究人员认为,这种新的机制可能与观察到的血栓形成有关慢性炎症并认为S100A8/A9与多种受体的相互作用使其成为脓毒症期间限制凝血和炎症的有趣靶点。
Rayes博士说:“血栓形成是感染期间的主要并发症,因此需要药物来靶向致病性凝血,同时保持血管完整性和正常凝血过程(止血)。通过选择性靶向S100A8/A9,我们的目标是靶向一个关键的病原性炎症和血栓形成分子,以限制感染期间的炎症和血栓形成。”
Rayes副教授在第63届美国血液学学会年会2022年12月12日星期一(CST 16.30-18.05)。她预计将在2023年发表败血症研究的结果。
伯明翰企业大学已经提交了一份专利申请覆盖了S100A8/A9-GPIbα轴在慢性炎症性和血栓性疾病血栓治疗和预防中的靶向作用。