临床试验导致atezolizumab被批准用于晚期肺泡软部肉瘤

由美国国立卫生研究院下属的国家癌症研究所(NCI)领导的一项临床试验,首次批准了一种治疗晚期肺泡软部肉瘤(ASPS)的治疗方法。免疫治疗药物atezolizumab (Tecentriq)最近由美国食品和药物管理局(FDA)批准用于治疗成人和2岁及以上患有ASPS的儿童,这些ASPS已经扩散到身体的其他部位或无法通过手术去除。
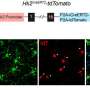
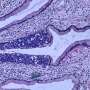
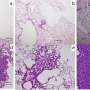
ASPS是一种极其罕见的癌症,主要影响青少年和年轻人。该批准基于一项非随机2期临床试验的数据(NCT03141684),由NCI癌症治疗与诊断部(DCTD)发育治疗临床的Alice Chen博士领导。基因泰克公司是罗氏集团的成员,生产atezolizumab,如果药物通过合作研发协议向NCI提供。这项研究的结果正在准备发表。
“40%的患者在贝塞斯达的NIH临床中心接受治疗,”DCTD主任詹姆斯·h·多罗秀(James H. Doroshow)说。“我们能够从世界各地招募患者,这是我们能够开展这项研究的关键因素。”
“对于一种治疗特别具有挑战性的罕见疾病,这项批准将产生巨大影响,”陈博士指出。
这是关于ASPS最大的研究。这也是第一次在实验疗法临床试验网络这导致了一种药物的批准。该网络使肉瘤专家在学术医疗中心从北美各地招募患者参加试验。
“这对实验治疗临床试验网络的研究人员、ASPS患者社区以及罕见癌症研究来说都是一个重要的里程碑,”该研究的领导者之一、DCTD的Elad Sharon医学博士说。
这也是atezolizumab首次被批准用于儿童。陈博士指出,这是由NCI癌症研究中心儿科肿瘤分支的参与实现的,该分支帮助招募儿童参加试验。
“这项研究是儿科肿瘤学和医学肿瘤学之间合作的一个重要例子,让患有非常罕见癌症的儿童获得有效的新疗法,”儿科肿瘤学分支的John W. Glod医学博士说。“整个研究团队感谢参与这项研究的患者,使这项工作成为可能。”
美国每年约有80人被诊断为ASPS。这种疾病通常始于连接和包围器官和其他组织的软组织。尽管这种疾病发展缓慢,但一旦传播,它往往是致命的,化疗也无效。大约50%的转移性疾病患者在5年后仍然存活。新的靶向治疗,包括被称为酪氨酸激酶抑制剂的药物,没有持久的效果。然而,最近免疫治疗药物已显示出可能治疗ASPS的前景。
Atezolizumab是一种抗pd - l1免疫检查点抑制剂,通过帮助免疫系统对癌症做出更强烈的反应来发挥作用。FDA已批准atezolizumab用于治疗几种癌症类型的患者,包括肝癌、黑色素瘤和肺癌癌症.
2020年,FDA授予atezolizumab突破性治疗资格,用于治疗不可切除或转移性ASPS患者。这意味着,用于治疗严重疾病的atezolizumab已符合FDA加速开发和审查药物的标准。同年晚些时候,FDA批准了针对软组织肉瘤的atezolizumab孤儿药称号。这种地位为公司开发治疗罕见疾病的药物提供了激励。
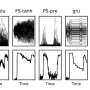
2期试验招募了49名年龄在2岁及以上的转移性ASPS患者,每21天给予atezolizumab输注。根据医生的评估,大约三分之一的患者对治疗有反应,肿瘤在一定程度上缩小了。其他大多数患者病情稳定。
在两年的治疗后,患者有机会停止治疗,并在密切监测下进行长达两年的治疗中断。在此期间,没有一个暂停治疗的患者出现疾病进展。
41%接受atezolizumab治疗的患者发生严重副作用;这些症状包括贫血、腹泻、皮疹、头晕、高血糖和四肢疼痛。然而,没有患者因为副作用退出研究。
“这一批准代表着罕见疾病的胜利,这些疾病在临床试验中研究不足,”陈博士说。“对于一种罕见疾病的批准,并能够对这些年轻人的生活产生影响,这是非常重要的。”
研究团队目前正在对ASPS患者进行atezolizumab的额外试验,包括将该药物与其他疗法联合使用。